Thông khí áp lực dương trong hồi sức tim mạch
- Tác giả: Carlos L. Alviar, P. Elliott Miller, …
- Chuyên ngành: Hồi sức cấp cứu
- Nhà xuất bản:Ths. Bs Hồ Hoàng Kim (dịch)
- Năm xuất bản:2022
- Trạng thái:Chờ xét duyệt
- Quyền truy cập: Cộng đồng
Thông khí áp lực dương trong hồi sức tim mạch
Carlos L. Alviar, P. Elliott Miller, …
TÓM TẮT
Các đơn vị chăm sóc tích cực về tim hiện đại (CICU) cung cấp chế độ chăm sóc cho một nhóm bệnh nhân già và ngày càng phức tạp. Sự phức tạp bệnh lý y khoa của dân số này một phần do sự gia tăng tỷ lệ bệnh nhân bị suy hô hấp cần thở máy áp lực dương không xâm lấn hoặc xâm lấn (PPV). PPV thường đóng một vai trò rất quan trọng trong việc quản lý bệnh nhân bị phù phổi, sốc tim hoặc ngừng tim và những người trải qua hỗ trợ tuần hoàn cơ học. PPV không xâm lấn, khi nó được áp dụng phù hợp cho bệnh nhân được chọn lọc, có thể làm giảm nhu cầu sử dụng PPV cơ học xâm lấn và cải thiện khả năng sống còn. PPV xâm lấn có thể là một cứu cánh, nhưng có cả tương tác thuận lợi và bất lợi về sinh lý giữa thất trái và phải và có nguy cơ xuất hiện biến chứng ảnh hưởng đến tỷ lệ tử vong của CICU. Triển khai PPV hiệu quả tại các đơn vị hồi sức tim đòi hỏi sự hiểu biết về sinh lý bệnh tim và phổi tiềm ẩn. Các bác sĩ tim mạch thực hành trong CICU nên thành thạo thuần thục các chỉ định, lựa chọn phù hợp, các cơ chế tương tác tim phổi tiềm năng và các biến chứng của PPV, nếu không, sẽ làm cho bệnh nhân chết nhanh hơn.
KEY WORDS: đơn vị chăm sóc mạch vành tích cực, suy tim, thở máy, thở không xâm lấn, phù phổi, suy hô hấp.
Đơn vị chăm sóc tim mạch tích cực (CICU) được phát triển từ một đơn vị tập trung vào theo dõi rối loạn nhịp tim và can thiệp mạch vành cấp đến một môi trường phức tạp chăm sóc bệnh nhân mắc các bệnh tim mạch với rối loạn chức năng đa cơ quan và bệnh lý nặng đồng mắc không do bệnh tim (1,2). Những lý do phổ biến trước đây để nhập CICU, bao gồm nhồi máu cơ tim cấp tính (MI), đã giảm dần trong tỷ lệ xuất hiện trong hồi sức tim, trong khi các chẩn đoán chính không do tim, như nhiễm trùng huyết, suy thận cấp và suy hô hấp, đã tăng (3). Một phân tích dữ liệu của Medicare từ năm 2003 đến 2013 cho thấy một tỷ lệ đáng kể bệnh nhân nhập CICU ở Hoa Kỳ có chẩn đoán chính không do tim, chủ yếu do nhiễm trùng và bệnh hô hấp (4). Trong môi trường CICU thay đổi như vậy, điều quan trọng hơn là các bác sĩ tim mạch có thể quản lý các khía cạnh của chăm sóc quan trọng chung của bệnh nhân của họ, bao gồm thông khí áp lực dương không xâm lấn (NI-PPV) và thở máy áp lực dương xâm lấn (IM-PPV) (3-5). Điều trị bằng thông khí áp lực dương (PPV) đã tăng lên gần 15% số nhập viện trong nhóm dân số Medicare năm 2013 (4,5).
Các bác sĩ tim mạch chịu trách nhiệm chính cho bệnh nhân trong CICU nên có kiến thức vững chắc về các ứng dụng dựa trên bằng chứng của NI- và IM-PPV và các tương tác tim phổi của chúng, có thể điều chỉnh các chiến lược thông khí cho từng bệnh nhân mắc bệnh tim mạch. Hơn nữa, bất kỳ bác sĩ tim mạch nào chăm sóc bệnh nhân trong CICU nên có kiến thức thực hành về các can thiệp này. Trong nửa đầu của tổng quan này, chúng tôi đề cập đến các khái niệm cơ bản về cơ học phổi và PPV; trong nửa sau, chúng tôi thảo luận về các ứng dụng lâm sàng cụ thể của các khái niệm này trong CICU. Trong mỗi phần, chúng tôi đã nhấn mạnh các nguyên tắc chính có liên quan rộng rãi và xác định các yếu tố tập trung vào lợi ích của chăm sóc nâng cao . Khi có thể, chúng tôi đã nhắm đến việc cung cấp một khung hoặc lời khuyên thực tế có thể hữu ích cho bác sĩ lâm sàng dựa trên kinh nghiệm của nhóm viết và trên dữ liệu được công bố. Với các nghiên cứu chất lượng mạnh được thiết kế đặc biệt để đánh giá PPV trong CICU, những điểm thực hành này không nhằm mục đích hướng dẫn thực hành lâm sàng chính thức (chỉ hy vọng người đọc làm CICU thay đổi quan điểm chút chút-ND).
NHỮNG NỘI DUNG CƠ BẢN VỀ CƠ HỌC PHỔI VÀ SINH LÝ TIM-PHỔI
Hệ thống tim mạch và phổi hoạt động trong một mối quan hệ chặt chẽ (khẩu quyết tâm pháp: "Một cái bơm hoạt động trong một cái bơm"-ND) và những thay đổi trong một hệ thống thường ảnh hưởng đến hệ thống khác (6,7). Do đó, những điều cơ bản của cơ học phổi (không chỉ là kiến thức nền cho bác sĩ ICU, hô hấp mà của cả các bác sĩ làm hay bị bắt làm CICU-ND) có liên quan đến tất cả các nhà lâm sàng thực hành hồi sức tim mạch chăm sóc bệnh nhân trải qua PPV. Các khái niệm chính được liệt kê trong Bảng 1.
ĐỊNH NGHĨA VÀ CÁC THÔNG SỐ CƠ HỌC PHỔI.
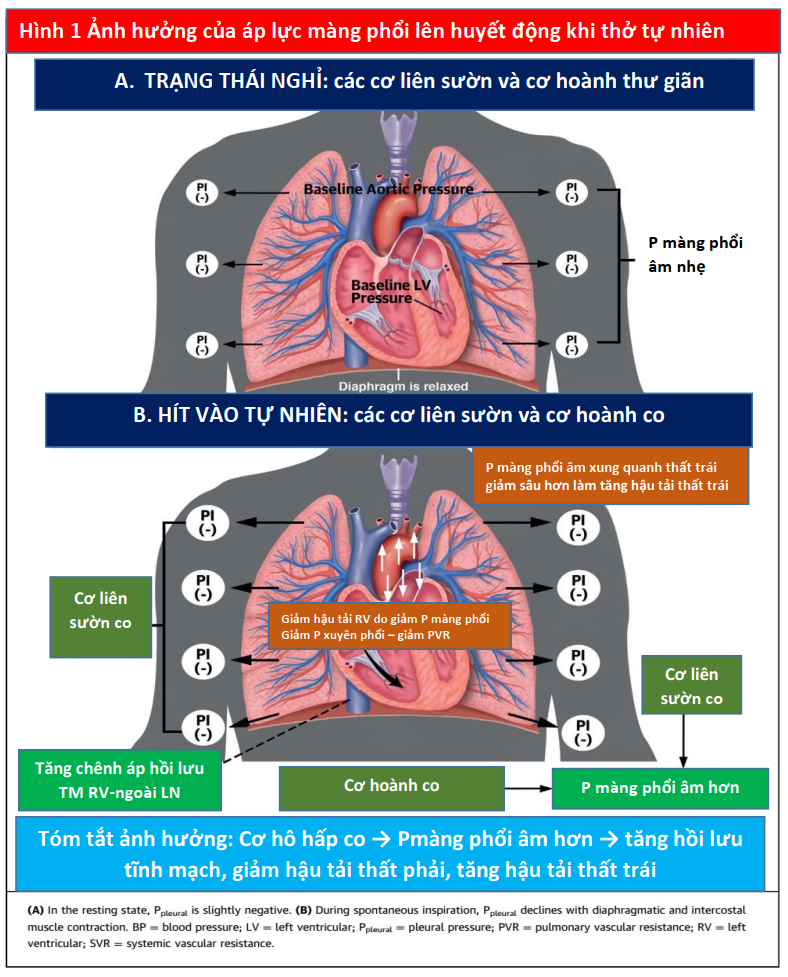
Áp suất trong khoang màng phổi (Ppleural), còn được gọi là áp lực trong lồng ngực, ảnh hưởng đến sinh lý tim mạch. Khi nghỉ, dung tích cặn chức năng được xác định bởi 2 lực đối lập: thành ngực có xu hướng kéo màng phổi nhô ra ngoài và các đơn vị nhu mô phế nang có xu hướng co rúm lại. Ở trạng thái nghỉ, Ppleural hơi âm (Hình 1A). Trong kỳ hít vào tự phát, sự co cơ của cơ hoành và cơ liên sườn làm cho Ppleural trở nên âm hơn, gây ra các hiệu ứng huyết động sau đó (Hình 1B). Trong giai đoạn suy hô hấp, các cơ hô hấp phụ trợ khác (ví dụ, cơ thang, ức đòn chủm…) được huy động. Thì thở ra thụ động xảy ra thông qua phế nang và thành ngực xẹp lại, làm cho Ppleural bớt âm hơn (8). Ở những bệnh nhân mắc bệnh phổi tắc nghẽn, thở ra cũng có thể cần một hoạt động gắng sức, sử dụng cơ bụng và cơ liên sườn trong thì thở ra cần dùng lực.
|
Bảng 1 Sinh lý phổi cơ bản và tương tác tim phổi |
|
Pmàng phổi ảnh hưởng đến tiền tải, hậu tải của thất phải và thất trái |
|
Pmàng phổi được xác định bởi sự cân bằng của xu hướng các đơn vị phế nang xẹp xuống (độ co giãn đàn hồi) so với thành ngực hướng ra ngoài và hoạt động của cơ hô hấp Những thay đổi trong Pmàng phổi thường ảnh hưởng đến dòng chảy vào RV và dòng chảy ra LV, trong khi những thay đổi về áp lực |
|
xuyên phổi (Pphế nang - Pmàng phổi) ảnh hưởng đến dòng chảy ra RV và dòng chảy vào LV. Pmàng phổi âm: a) làm tăng hồi lưu tĩnh mạch và tiền tải; b) giảm hậu tải RV; và c) tăng hậu tải LV. Thông khí áp lực dương làm tăng Pmàng phổi và a) giảm tiền tải; b) tăng hậu tải RV; và c) giảm hậu tải LV. Những thay đổi lớn trong Pmàng phổi (ví dụ, suy hô hấp) có thể làm tăng đáng kể hậu tải LV. |
|
PEEP ảnh hưởng lên huyết động của thất phải và trái |
|
Tổng PEEP là tổng của PEEP ngoại sinh (được tạo ra bởi máy thở) và PEEP nội tại hoặc tự động (do thở ra không hoàn toàn). PEEP ngoại sinh thường được sử dụng trong CICU vì các tác dụng có lợi của nó đối với quá trình oxy hóa, huy động phế nang, sự thông thoáng của đường thở và tiền tải. PEEP: a) làm tăng sức cản mạch máu phổi; b) giảm tiền tải RV và LV; c) giảm hậu tải LV; và d) làm giảm compliance LV thông qua sự tương tác 2 thất. Ảnh hưởng của PEEP đến cung lượng tim thay đổi tùy theo sự phụ thuộc tiền tải và sức co bóp và compliance LV. |
|
Ảnh hưởng của áp lực đường thở lên huyết động thông qua tác động của nó nên áp suất phế nang và màng phổi |
|
Áp lực đường thở được xác định bởi lưu lượng dòng khí, sức cản đường thở, thể tích thông khí, compliance của thành ngực và nhu mô phổi và tổng áp lực dương cuối thì thở ra. Thông khí áp lực dương phát huy tác dụng của nó đối với huyết động học tim mạch chủ yếu thông qua tác động của nó đối với áp suất phế nang và màng phổi. Trong phổi giảm compliance, những thay đổi về áp lực bên trong lồng ngực sẽ có tác dụng rõ rệt hơn đối với huyết động học. |
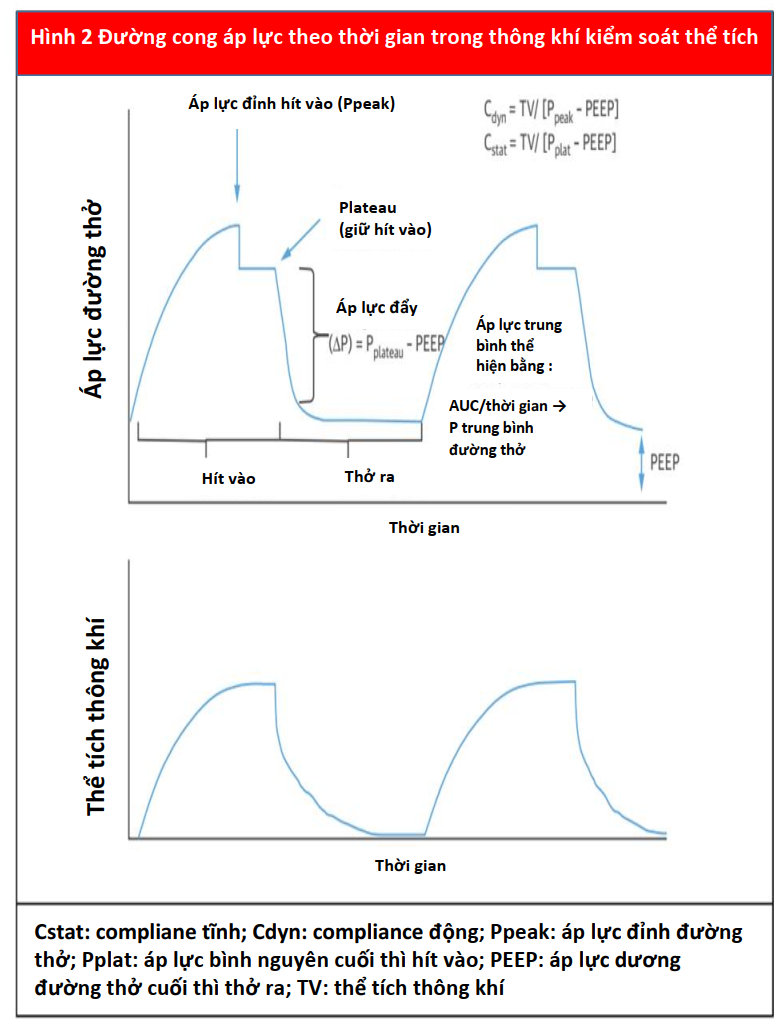
Compliance hô hấp và kháng trở đường thở là các thành phần quan trọng của cơ học phổi của nhịp thở tự nhiên và PPV. Tổng complicane của hệ hô hấp bao gồm nhu mô phổi và thành ngực. Compliance của phổi được định nghĩa là sự thay đổi về thể tích so với sự thay đổi áp suất (DV / DP) trong phế nang. Compliance của thành ngực bị ảnh hưởng bởi các yếu tố ngoài phổi, bao gồm tình trạng béo phì, sự biến dạng lồng ngực và áp lực trong ổ bụng, cũng như, hiếm khi, thuốc (ví dụ, co cứng thành ngực do fentanyl gây ra) (9). Áp lực bình nguyên (Pplat), có liên quan ở bệnh nhân thở PPV, hay gọi đúng hơn đó áp suất trong lòng phế nang (Palv) ở cuối thì hít vào và là Palv tối đa trong chu kỳ hô hấp. Ở những bệnh nhân thở máy, Pplat được đo trong thời gian tạm ngưng cuối thì thở vào (lưu lượng bằng 0) và có thể được sử dụng để ước tính tổng compliance (thể tích / [Pplat - áp lực dương cuối thì thở ra]). Sức cản của đường thở là sự thay đổi áp lực đối với dòng khí như được trình bày trong định luật Ohm, (lực cản = DP / lưu lượng dòng). Sức cản đường thở có liên quan đến đường kính của đường thở và có thể bị ảnh hưởng bởi co thắt phế quản, bệnh lý khí quản hoặc đường hô hấp trên, các nút chất nhầy đàm hoặc tái cấu trúc đường thở. Tăng sức cản đường thở cũng sẽ làm giảm compliance phổi động (Hình 2).
Các thông số PPV bổ sung ảnh hưởng đến tương tác tim phổi đòi hỏi phải xác định. Đầu tiên, áp lực dương cuối thì thở ra (PEEP) là áp suất trên áp suất khí quyển được duy trì trong suốt chu kỳ hô hấp để ngăn chặn sự sụp đổ phế nang cuối thì thở ra. Thứ hai, áp lực đường thở trung bình là áp suất trung bình trong toàn bộ chu kỳ thông khí (Hình 2). Thứ ba, áp lực đỉnh đường phản ánh áp lực cần thiết để vượt qua sức cản của đường thở và tạo ra thể tích thông khí (Vt). Khi Vt và compliance không đổi (ví dụ, trong quá trình thông khí kiểm soát thể tích), áp suất đỉnh đường thở tương quan với sức cản đường thở. Tuy nhiên, nếu compliance của phổi bị giảm, áp lực đỉnh sẽ tăng lên.
Đo Pplat bằng cách thực hiện tạm ngưng cuối thì thở ra có thể giúp phân biệt giữa những yếu tố này góp phần vào sự hình thành áp lực đường thở (Hình 2). Pplat sẽ cao hơn trong phổi giảm compliance. Thông số thứ tư là áp lực xuyên phổi, được định nghĩa là sự khác biệt giữa Palv và áp lực màng phổi (Palv - Ppleural), ảnh hưởng đến huyết động học ở tâm thất trái (LV) và tâm thất phải (RV). Do PPV làm tăng cả Palv và Ppleural, nên có thể khó ước tính chính xác áp lực xuyên phổi. Đối với các chăm sóc nâng cao, một bóng thực quản có thể được sử dụng để ước tính Ppleural và để tính áp lực xuyên phổi nếu có chỉ định (10).
CƠ HỌC PHỔI TRONG PPV.
PPV tạo ra độ chênh áp suất giữa máy thở và bệnh nhân để không khí di chuyển vào và ra khỏi phổi như được mô tả bởi phương trình chuyển động:
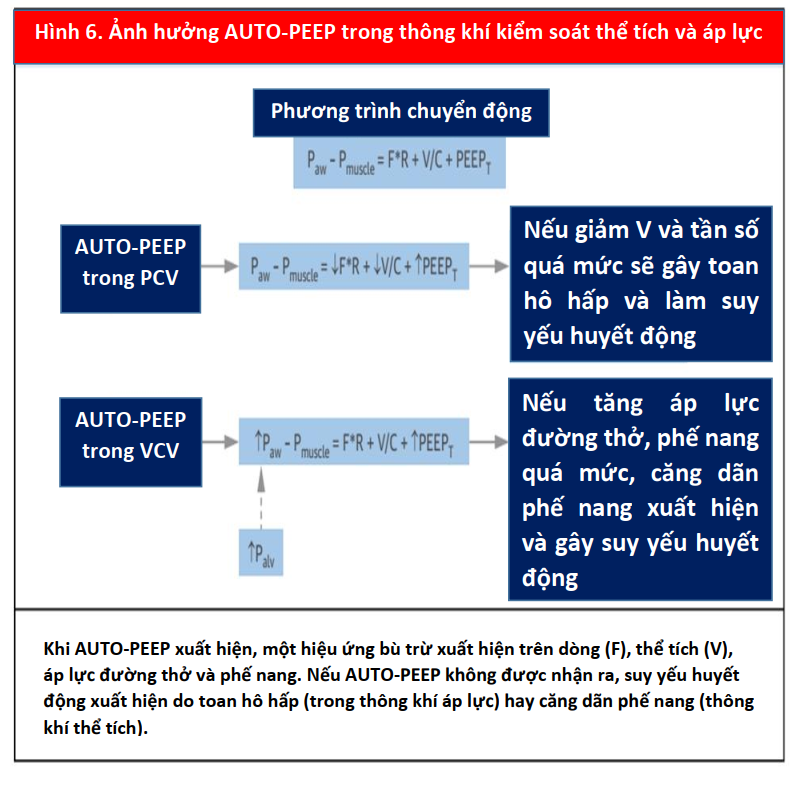
Paw - Pmuscle = F. R + V / C + PEEPT
Trong đó Paw là áp lực đường thở, Pmuscle là áp lực do các cơ bệnh nhân tạo ra, F là dòng chảy, R là sức cản, V là thể tích, C là compliance và PEEPT là tổng áp lực dương cuối thì thở ra (11). PEEPT là tổng số PEEP ngoại sinh (được tạo ra bởi máy thở) và PEEP nội tại hoặc tự động (do thở ra không hoàn toàn). Phương trình này phản ánh một cách toán học rằng áp suất cực đại (Ppeak) trong hệ thống là tổng áp lực dương cuối thì thở ra (PEEPT), áp suất được tạo ra bởi sự biến đổi của phế nang trong thì thở vào (V/C) và áp suất được tạo ra bởi sức cản trong đường thở (F. R). Áp lực trong phế nang (Palv) được phản ánh bởi V / C + PEEPT.
PEEP ngoại sinh thường được sử dụng trong CICU do tác dụng có lợi đối với quá trình oxy hóa (do mối quan hệ tuyến tính giữa PEEP và áp suất riêng phần của oxy), huy động phế nang, thông thoáng đường thở và tiền tải (12,13). Mức PEEP thấp ( < 5 cmH2O) thường được sử dụng ở những bệnh nhân được đặt nội khí quản để duy trì sự thông thoáng đường thở và tránh tình trạng xẹp phổi. Mặc dù không có PEEP tối ưu được thiết lập, một phạm vi với mức PEEP cao hơn có thể hữu ích cho một số tình trạng, bao gồm suy tim (HF) và phù phổi không do tim mạch (13,14). PEEP thường an toàn khi được sử dụng và theo dõi đúng cách cùng với Ppeak, Pplat và Vt (13).
Trong PPV, thở ra là một quá trình thụ động, trong đó Palv trở thành áp lực đẩy và giảm dần từ mức tối đa (Pplat) xuống áp suất cuối kì thở ra (PEEPT), bởi các thành phần bên ngoài và bên trong được xác định trong phần trước đó (Hình 2). Trong giai đoạn này, Palv > Paw, được xác định bởi PEEP ngoại sinh do bác sĩ lâm sàng cài đặt. Là một khái niệm tiên tiến, lượng không khí bị giữ lại trong phổi khi kết thúc thở ra phụ thuộc vào tốc độ không khí thoát ra khỏi phổi nhanh như thế nào, do đó được xác định bởi thời gian thở ra vốn bị ảnh hưởng bởi sức đề kháng và compliance. Bệnh nhân có kháng trở cao (ví dụ, bệnh phổi tắc nghẽn mạn tính [COPD]) cần thời gian thở ra lâu hơn và dễ bị nội sinh hóa PEEP, đặc biệt ở những người có thể tích phổi cao (ví dụ, khí phế thũng).
Khi xem xét việc quản lý PPV ở bệnh nhân tim, như được mô tả trong các phần tiếp theo, một khái niệm cơ bản là đặc điểm đường thở và phổi của bệnh nhân (sức đề kháng và sự compliance) xác định mối quan hệ giữa các thông số của bác sĩ cài đặt và kết quả đạt được về thể tích, áp lực và lưu lượng dòng khí.
PPV VÀ SINH LÝ THẤT TRÁI.
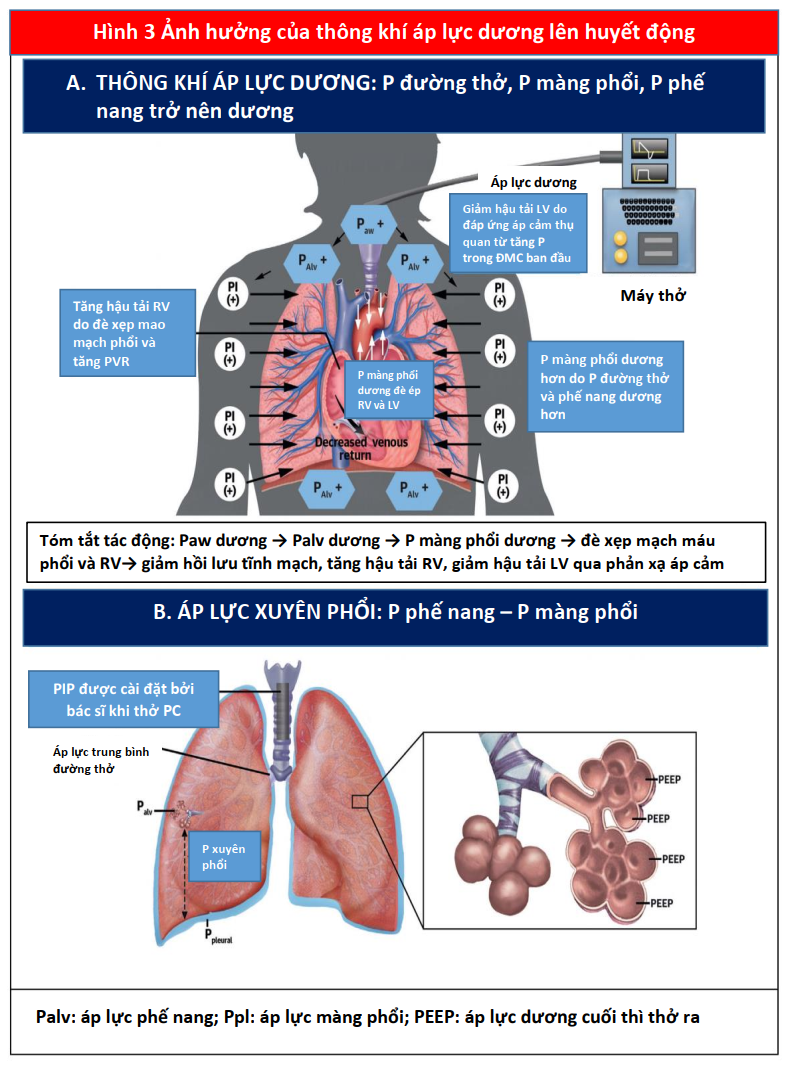
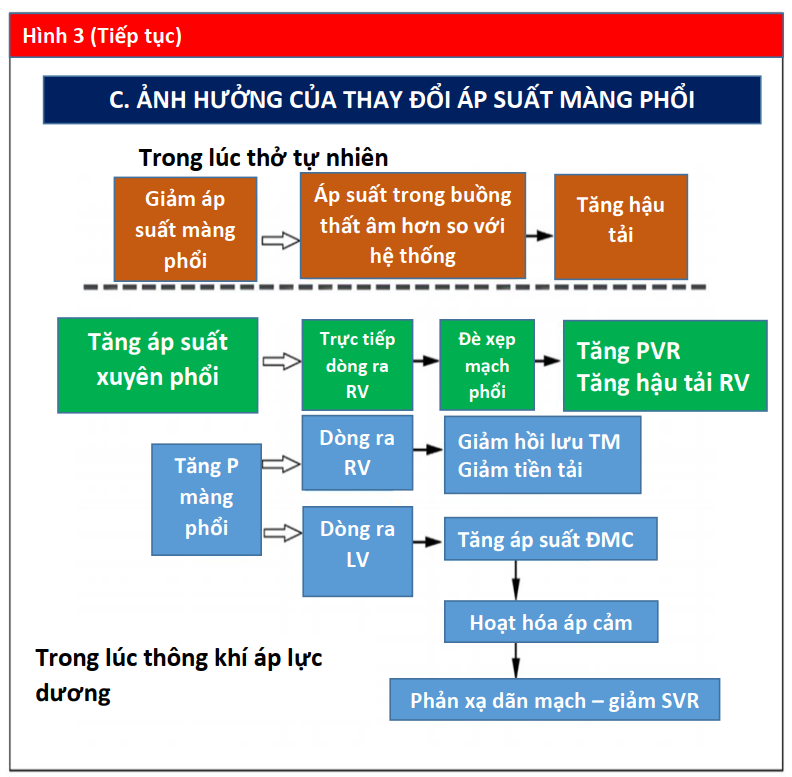
PPV phát huy tác dụng của nó đối với huyết động học tim mạch chủ yếu thông qua tác dụng của nó đối với Palv và Ppleural. Cả Ppeak và áp lực dương cuối thì thở ra (được xác định bằng PEEP) đều ảnh hưởng đến huyết động học (Hình 3). Áp lực xuyên phổi cũng ảnh hưởng đến RV và LV. Nói chung, những thay đổi áp lực trong khoang màng phổi ảnh hưởng đến dòng chảy vào RV và chảy ra từ LV, trong khi đó thay đổi áp lực xuyên phổi (Palv-Ppleural) ảnh hưởng dòng chảy ra RV và chảy vào LV bằng cách ảnh hưởng đến mạch máu phổi. Do đó, khi Ppleural giảm, áp suất tâm thu LV trở nên âm hơn so với tuần hoàn hệ thống làm tăng hậu tải LV (Hình 3) (15).
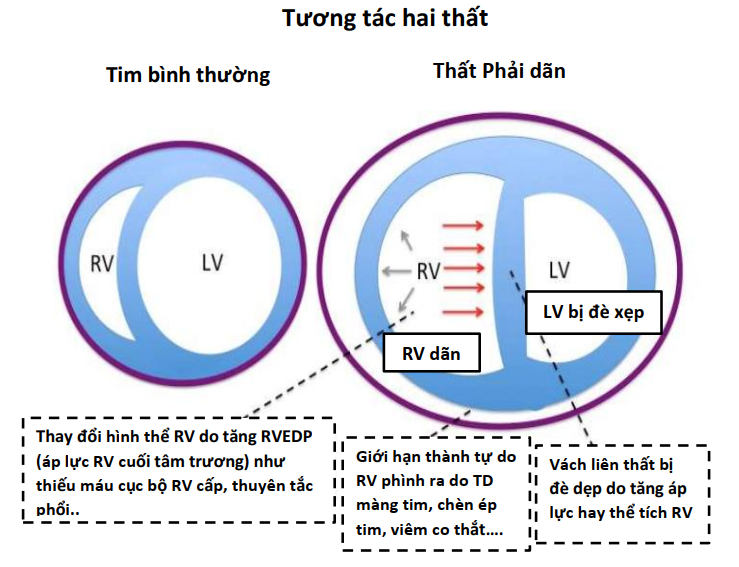
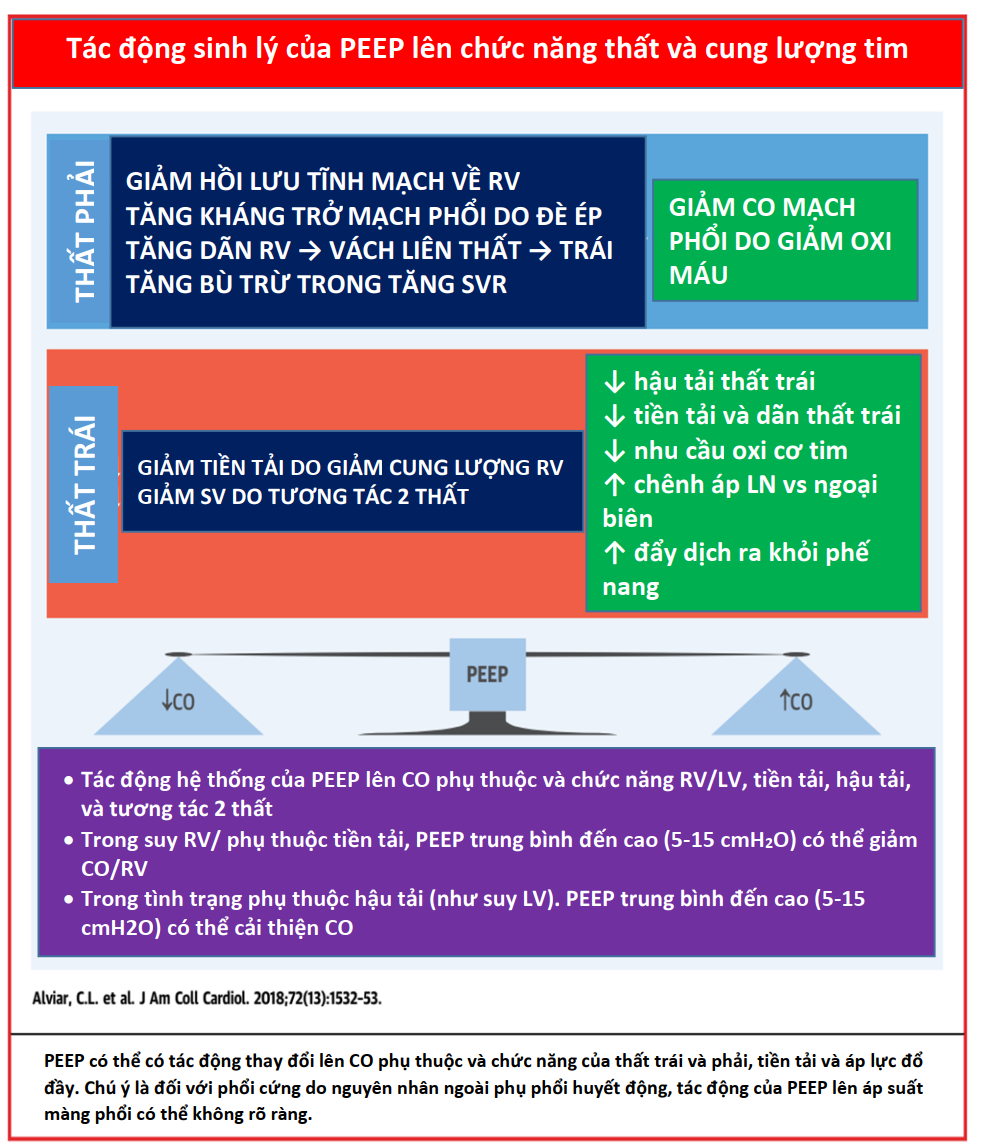
Các nghiên cứu thử nghiệm và in vivo đã chứng minh sự tương tác giữa PPV và tiền tải và hậu tải của LV (Bảng 2) (6,7,16). Trong PPV, sức căng thành LV không đổi do sự gia tăng tương đương của Ppleural, áp lực động mạch chủ và áp lực LV, tạo ra độ chênh dòng chảy giữa ngực và các cơ quan ngoại vi (hiệu ứng giống như bơm bóng động mạch chủ). Khi Ppleural tăng, ban đầu áp lực động mạch chủ tăng lên, kích hoạt quá trình tự động hóa bằng các baroreceptor ngoại biên làm giảm sức cản mạch máu hệ thống và hậu tải LV (17), cải thiện cung lượng tim (CO) (Hình 3) (14). Ngoài ra, ở những bệnh nhân có LV giãn và áp lực đổ đầy cao, trong đó có trào ngược (hở) van hai lá chức năng (MR) làm suy yếu CO, PEEP có thể cải thiện đường kính tâm thất và MR (18,19). Ngoài ra, thông qua sự tương tác của hai thất lẫn nhau, ảnh hưởng của PPV trên RV, cuối cùng có thể ảnh hưởng đến hiệu suất LV. Một RV bị quá tải và giãn nở có thể làm dịch chuyển vách liên thất về phía LV, làm giảm tiền tải LV và thể tích nhát bóp (Hình 2) (20,21). Những ảnh hưởng của PEEP đối với huyết động học LV và RV sẽ xác định ảnh hưởng liên hoàn đối với CO.
PPV VÀ ẢNH HƯỞNG SINH LÝ LÊN THẤT PHẢI.
PPV có thể có tác dụng quan trọng đối với tiền tải, hậu tải RV và tưới máu cơ tim. Trong quá trình thở tự nhiên, Ppleural âm được tạo ra trong khi hít vào làm tăng hồi lưu tĩnh mạch, tiền tải và làm đầy RV (22). Do độ chênh áp lực giữa tuần hoàn tĩnh mạch và RV thường chỉ khoảng 4 đến 8 mm Hg (23), những thay đổi nhỏ trong Ppleural có thể tạo ra hiệu ứng tương đối lớn đối với hồi lưu tĩnh mạch và CO (22,23). Khi Ppleural giảm, độ chênh tĩnh mạch - RV tăng và tiền tải tăng.
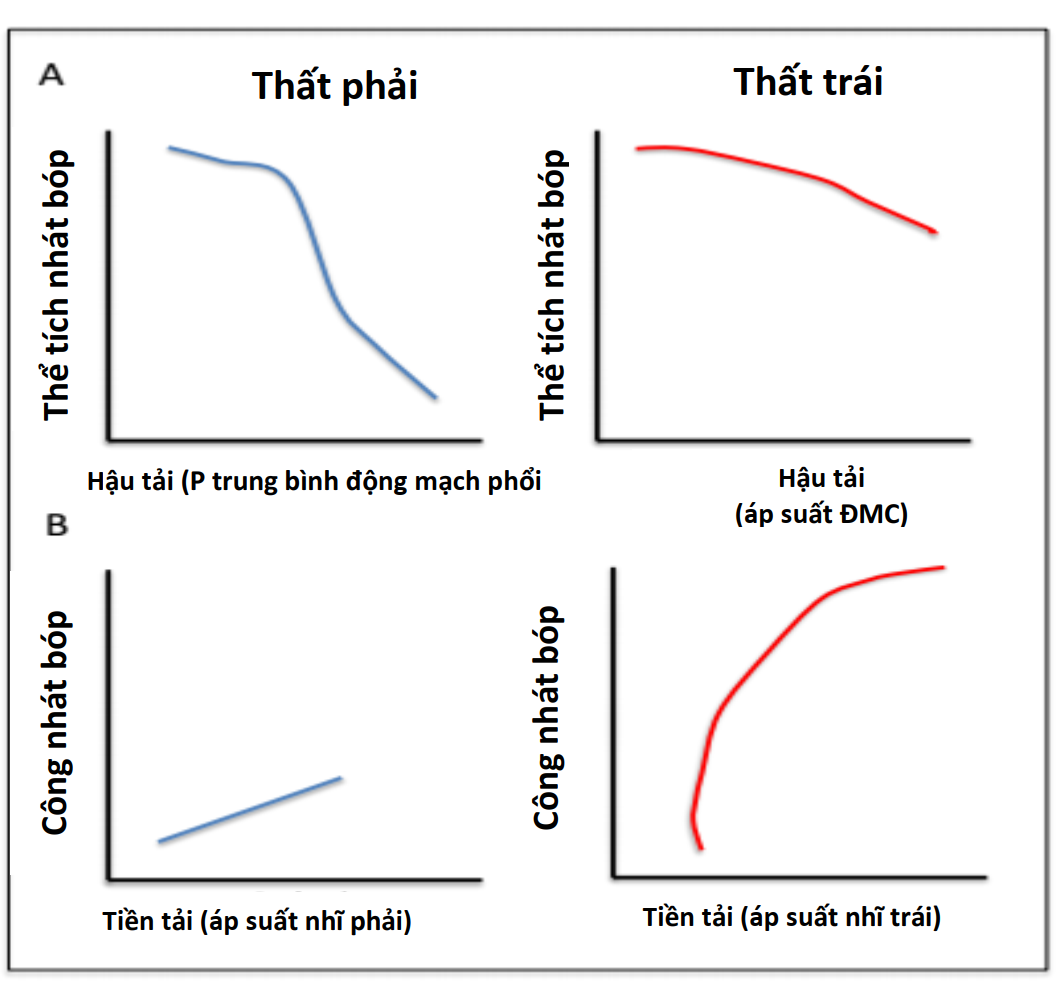
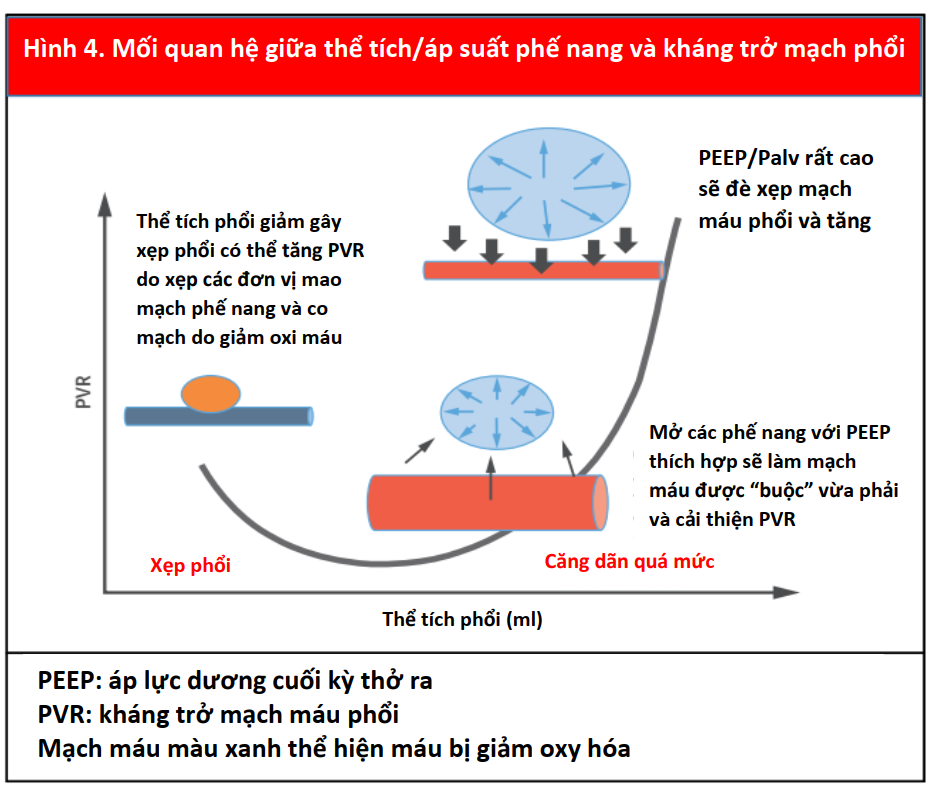
Ngược lại, trong PPV, máy thở tạo ra áp lực dương, được truyền vào Palv và Ppleural, dẫn đến áp lực xuyên phổi dương hơn (PalvPpleural). Cả PEEP và Paw trung bình có ảnh hưởng trực tiếp đến các điều kiện tải của tim (Minh họa trung tâm). Trong PPV xâm lấn và không xâm lấn, tăng PEEP và Ppleural làm giảm hồi lưu tĩnh mạch và do đó giảm tiền tải RV (Hình 3) (15). Đồng thời, PPV tăng hậu tải RV sau khi tăng áp lực xuyên phổi gây xẹp vi mạch và tăng sức cản mạch máu phổi (PVR). Tương tự, việc sử dụng PEEP có thể tăng hậu tải RV. Thông qua các tác động của nó lên thể tích phổi, PEEP có hiệu ứng hình chữ U trên PVR. Bằng cách làm giảm tình trạng xẹp phổi, PEEP có thể mở phế nang, tăng cường thể tích phổi và thuận lợi cho các mạch máu, giảm PVR và cải thiện lưu lượng máu (24). Tuy nhiên, PEEP cao có thể gây ra tình trạng quá tải phế nang nén các mạch ngoài bên ngoài xung quanh, làm tăng PVR và dẫn đến sự chuyển hướng lưu lượng máu đến các khu vực thông khí kém, làm tăng sự không phù hợp của V / Q tạo tình trạng thiếu oxy và tăng CO2 máu (Hình 4) (25).
Những thay đổi trong Ppleural phản ánh những thay đổi trong Palv do PEEP phụ thuộc nhiều vào compliance phế nang. Ví dụ, ở những bệnh nhân bị phù phổi do tim (CPE), compliance phổi bị giảm do phù kẽ và phế nang chứa đầy dịch. Khi PEEP giảm tiền tải và đồng thời tạo ra áp suất thủy tĩnh để đẩy chất lỏng ra khỏi phế nang, compliance và trao đổi khí được cải thiện, và do đó tạo ra PVR. Tuy nhiên, ở những bệnh nhân phổi bị giảm compliance do các nguyên nhân khác (ví dụ, hội chứng suy hô hấp cấp tính [ARDS]), tác dụng của PEEP đối với Ppleural và tiền tải không rõ rệt. Ở những bệnh nhân như vậy, ngay cả một lượng nhỏ PEEP với những thay đổi nhỏ trong Palv có thể làm tăng hậu tải RV một cách không cân xứng bằng cách làm xấu đi PVR và làm suy yếu lưu lượng máu phổi (26). Bệnh nhân rối loạn chức năng RV đặc biệt nhạy cảm với tác dụng phụ này trên PVR (Minh họa trung tâm).
Sự tưới máu cơ tim của RV phụ thuộc vào Ppleural, áp lực RV và áp lực động mạch chủ, do đó bị ảnh hưởng bởi PPV. Trong PPV ở bệnh nhân bình thường, áp lực động mạch chủ vẫn cao hơn áp lực Ppleural và RV, duy trì tưới máu cơ tim. Tuy nhiên, ở những bệnh nhân có áp lực động mạch chủ thấp (ví dụ: sốc), tưới máu RV có thể bị tổn thương do tăng Ppleural từ PEEP cao hoặc Paw cao (27). Khối lượng cơ tim hạn chế của thành RV làm cho nó nhạy cảm hơn với những thay đổi về hậu tải so với thay đổi trong tiền tải (17), trong khi điều ngược lại là đúng với LV (Hình 3). Do đó, cân nhắc từng tác dụng phụ tiềm ẩn này, PEEP nên được sử dụng thận trọng ở những bệnh nhân bị suy RV (17). Hơn nữa, ở những bệnh nhân bị rối loạn chức năng RV thứ phát sau bệnh phổi tắc nghẽn (ví dụ, COPD), việc theo dõi và ngăn ngừa PEEP nội sinh đặc biệt quan trọng để tránh gây mất ổn định huyết động và để ngăn ngừa chấn thương khí áp (Hình 4) (28).
|
BẢNG 2 Tác dụng có lợi của thông khí áp lực dương ở bệnh nhân rối loạn chức năng thất phải và trái |
||
|
|
Cơ chế |
Hiệu quả |
|
Hiệu ứng trực tiếp từ PEEP |
Giảm hậu tải LV Giảm đường kính LV, dẫn đến giảm MR Tăng áp lực xuyên thành Tăng Palv tại cuối thì thở ra |
LV được giảm tải Cải thiện cung lượng tim Cải thiện cung lượng tim Cải thiện compliance phổi (nghĩa là, ngăn ngừa xẹp của phế nang) |
|
Ảnh hưởng từ hoặc lên trao đổi khí |
Đảo ngược tình trạng co mạch do thiếu oxy Giảm tiền tải Cải thiện tương hợp thông khí / tưới máu |
Giảm hậu tải RV Cải thiện sung huyết phổi Cải thiện oxy hóa máu |
|
Tác dụng từ hỗ trợ thông khí |
Giảm công thở Cải thiện tăng CO2 máu và nhiễm toan |
Cải thiện tưới máu mô Giảm tiêu thụ oxy của cơ tim Cải thiện hậu tải của thất phải |
|
Tác động lên hệ thống |
Tối ưu hóa trao đổi khí, do đó oxy hóa và tưới máu mô |
Cải thiện nhu cầu trao đổi chất và tưới máu ngoại vi |
PHƯƠNG THỨC VÀ ỨNG DỤNG OXI HÓA MÁU VÀ HỖ TRỢ THÔNG KHÍ TẠI CICU
THỞ OXI LƯU LƯỢNG CAO QUA CANNULA MŨI.
Thở qua cannula mũi tiêu chuẩn được giới hạn ở lưu lượng tối đa 6 l/phút, và có thể không đáp ứng nhu cầu của bệnh nhân thiếu oxy nghiêm trọng. Khi so sánh, thở lưu lượng cao qua cannula mũi (HFNC) cung cấp một dòng chảy nóng và ẩm lên đến 60 l/phút (29). Bằng cách sử dụng tốc độ dòng chảy cao hơn nhu cầu hô hấp của bệnh nhân, HFNC có thể cung cấp FiO2 hít vào đáng tin cậy (30). Cùng với quá trình oxy hóa được cải thiện, với tốc độ dòng chảy cao, HFNC cung cấp tới gần cmH20 PEEP (29). Mặc dù 1 thử nghiệm ngẫu nhiên đã cho thấy tỷ lệ tử vong với HFNC thấp hơn so với NI-PPV (31), các thử nghiệm khác đã chỉ ra kết quả tương tự (32). Không có thử nghiệm ngẫu nhiên có đối chứng HFNC đặc biệt ở trên bệnh nhân phù phổi cấp (33).
THÔNG KHÍ ÁP LỰC DƯƠNG KHÔNG XÂM LẤN.
NI-PPV là một phương thức quan trọng để quản lý bệnh nhân trong CICU. NI-PPV bao gồm áp lực đường thở dương liên tục (CPAP) và áp lực đường thở dương hai mức (BiPAP). Trong khi CPAP cung cấp PPV liên tục, BiPAP cung cấp riêng áp lực đường thở dương thì hít vào (IPAP) và áp lực đường thở dương cuối thì thở ra (EPAP) (tương đương về chức năng với PEEP trong IM-PPV). BiPAP có thể làm giảm công việc hô hấp, tăng Vt nhiều hơn CPAP và cải thiện thông khí ở bệnh nhân tăng CO2 máu. Lựa chọn bệnh nhân phù hợp là nguyên tắc không thể thiếu để sử dụng thành công NI-PPV (Bảng 3) (34)Có một số mask thở có sẵn cho NIPPV, bao gồm mặt nạ toàn mặt (che mũi, miệng và mắt), mặt nạ mũimiệng hoặc mặt, mặt nạ mũi và gối mũi. Mặc dù tất cả các mặt nạ đều có ưu điểm và nhược điểm (Bảng 1), mặt nạ che cả mũi và miệng được ưu tiên để giảm thiểu rò rỉ (35).
Cách cài đặt NI-PPV ban đầu trong các thử nghiệm ngẫu nhiên có đối chứng đã thay đổi. CPAP và EPAP thường được điều chỉnh theo mức oxy hóa và IPAP (chỉ BiPAP) được sử dụng để kiểm soát thông khí (PaC02). Đối với CPAP, áp lực khởi động thường được chọn là 5 đến 10 cmH2O, với điều chỉnh mỗi 2 cmH2O mỗi lần. Nếu BiPAP được sử dụng, cài đặt ban đầu thường là IPAP là 10 cmH2O và EPAP là 5 cmH2O. Điều chỉnh IPAP mỗi lần từ 2 đến 3 cmH2O có thể được thực hiện để cải thiện tình trạng tăng CO2 máu, tránh IPAP > 20 cmH2O để ngăn chặn tình trạng bơm khí vào dạ dày và giảm thiểu nguy cơ hít sặt (36). FiO2 có thể bắt đầu ở mức cao và được điều chỉnh cho mục tiêu Sa02 (ví dụ: 94% đến 98%) trong khi tránh Sa02 > 98%. Xu hướng đồng thuận trong việc tránh tăng oxy máu bắt nguồn từ mối liên quan được quan sát giữa 02 liệu pháp ở bệnh nhân không giảm oxi máu và tỷ lệ tử vong cao hơn (37), bao gồm một số bệnh tim mạch, như hội chứng mạch vành cấp, suy tim, đột quỵ và ngừng tim (38,39) .
|
BẢNG 3 Chỉ định và chống chỉ định với thông khí áp lực dương không xâm lấn |
|
|
Chỉ định NI-PPV |
Chống chỉ định NI-PPV |
|
Phù phổi do tim Suy hô hấp có tăng CO2 máu Đợt cấp bệnh COPD Rút ống nội khí quản nguy cơ cao Bệnh nhân suy giảm miễn dịch bị suy hô hấp Bệnh thần kinh cơ Chấn thương (chấn thương ngực) Hỗ trợ thở máy ở bệnh nhân chăm sóc giảm nhẹ Suy hô hấp sau phẫu thuật |
Cần bảo vệ đường thở hiệu quả vì tình trạng tri giác thay đổi, bệnh nhân không hợp tác, ngưng thở, ngừng tim hoặc co giật Biến dạng khuôn mặt vì bệnh lý, phẫu thuật gần đây hoặc chấn thương Mất ổn định huyết động Nguy cơ hít sặc cao (ói, không có khả năng kiểm soát dịch tiết) Phẫu thuật gần đây đường thở hoặc đường tiêu hóa |
Nếu NI-PPV thành công, bệnh nhân thường sẽ cho thấy sự cải thiện, chẳng hạn như giảm nhịp hô hấp, cải thiện công hô hấp và trao đổi khí được cải thiện, trong vòng1 đến 2 giờ.
Ở những bệnh nhân được lựa chọn tốt, tác dụng phụ rất ít và chủ yếu liên quan đến khả năng dung nạp của thiết bị / mặt nạ (40,41). Các tác dụng phụ nghiêm trọng hơn có thể xảy ra, bao gồm hít sặc, tajonust nhầy do đàm kẹo đặc hoặc hạ huyết áp (40). Bảng 2 trực tuyến mô tả các yếu tố liên quan đến thất bại NI-PPV.
PPV XÂM LẤN CƠ HỌC(IM-PPV).
Các chỉ định cho IM-PPV bao gồm thiếu oxy hoặc tăng CO2 kháng trị, công thở không bền vững và cần bảo vệ đường thở trong tình trạng tri giác thay đổi, ngừng thở,tim, ngừng thở do huyết động / suy hô hấp, nôn mửa hoặc chảy máu đường tiêu hóa. Các chế độ của IM-PPV là các thuật toán định sẵn đưa ra mô hình thở bắt buộc và tự phát được cung cấp bởi máy thở và chuyển thành các tương tác máy thở của bệnh nhân cụ thể. Chế độ nên được điều chỉnh theo bệnh cảnh lâm sàng để mang lại lợi ích lớn nhất với nguy cơ biến chứng thấp nhất, đồng thời tối ưu hóa sự thoải mái của bệnh nhân và dễ dàng giải phóng khỏi IM-PPV (42).
Hơn 300 tên độc quyền đại diện cho khoảng 50 chế độ thở. Không có dữ liệu thuyết phục để hỗ trợ tính ưu việt của bất kỳ chế độ cụ thể nào đối với một bệnh nhất định ở nhóm người lớn. Mặc dù không có sự đồng thuận để phân loại các chế độ IM-PPV, một danh pháp đơn giản hóa đã được đề xuất (42) dựa trên ba yếu tố: thông số kiểm soát (áp suất, hoặc thể tích / lưu lượng), kiểu thở (thông khí bắt buộc liên tục, thông khí bắt buộc gián đoạn, hoặc thông khí tự phát liên tục) và sơ đồ nhắm mục tiêu (một mẫu máy thở cụ thể để đáp ứng với phản hồi của bệnh nhân) (Hình 5 trực tuyến). Chi tiết về phân loại này được giải thích ở nơi khác (42).
|
BẢNG 4 Cách tiếp cận đơn giản hóa các chế độ của thông khí cơ học xâm lấn áp lực dương |
||
|
Thông khí kiểm soát thể tích |
Thông khí kiểm soát áp lực |
Thông khí hỗ trợ áp lực |
|
Các thông số độc lập là thể tích và lưu lượng Thông số phụ thuộc là áp suất |
Thông số độc lập là áp suất Các thông số phụ thuộc là thể tích và lưu lượng |
|
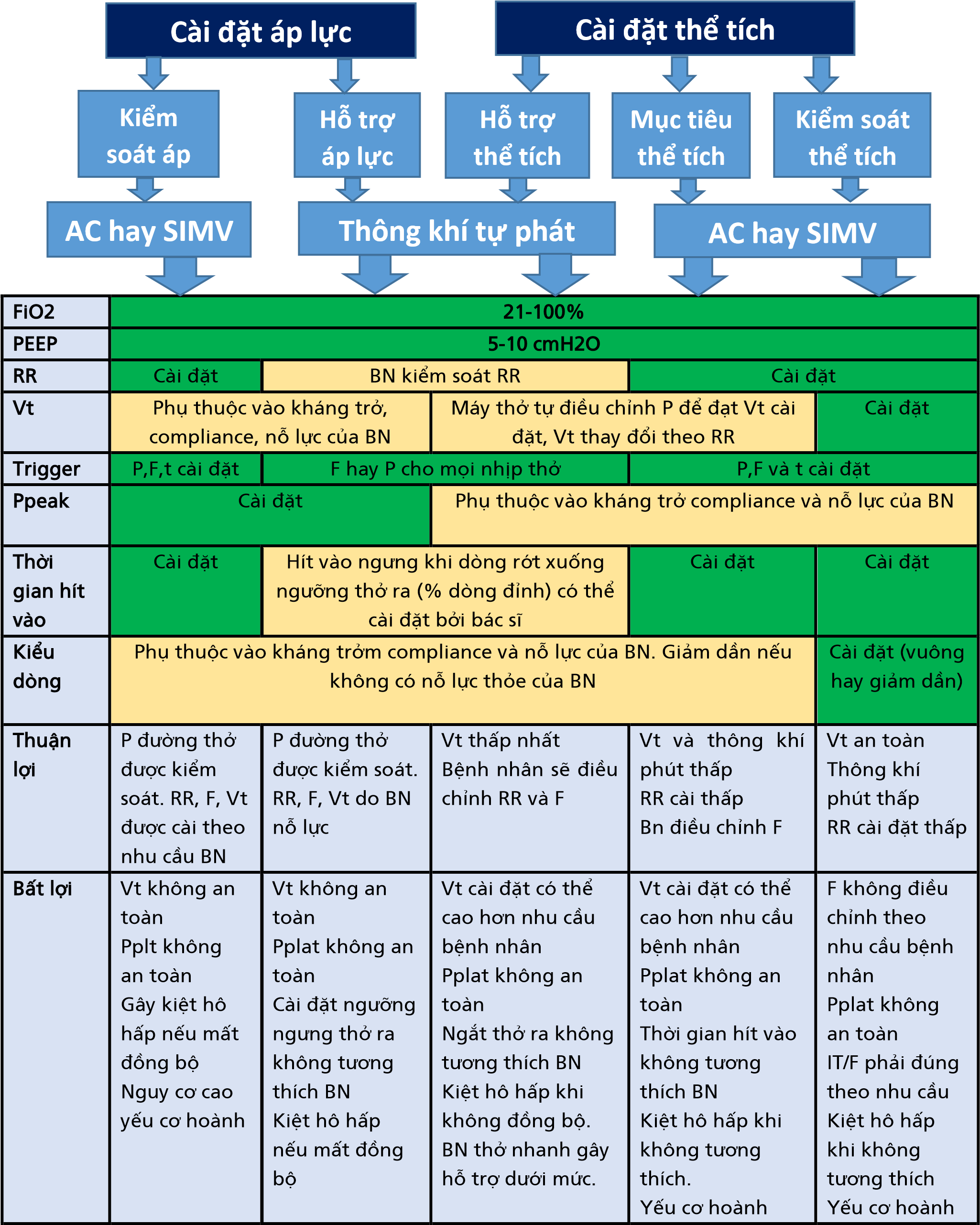
Quản lý cài đặt máy thở. Khi bắt đầu và quản lý IM-PPV, 4 yếu tố chính (kích hoạt, thông số kiểm soát thì hít vào, chy kỳ và PEEP trong giai đoạn thở ra) cần được xem xét liên quan đến từng giai đoạn của hơi thở. Các yếu tố này được trình bày trong Hình 5 và được giải thích chi tiết cho người đọc quan tâm trong Bảng trực tuyến 3. Biến kiểm soát được chọn lựa và cài đặt bởi bác sĩ lâm sàng và mô tả cách máy thở điều chỉnh lượng thể tích hoặc áp suất để cung cấp trong mỗi nhịp thở bao gồm cả thông khí kiểm soát áp suất hoặc thông khí kiểm soát thể tích. Một loại kiểm soát khác là thông khí nhắm mục tiêu thể tích, đó là chế độ điều khiển kép với Vt mục tiêu đã cài đặt, cho phép máy thở tự động điều chỉnh mức áp suất để đạt được mức Vt mục tiêu (ví dụ, có nghĩa là, VC+, hay hoặc "autoflow").
Hiện tại, các chế độ IM-PPV được sử dụng phổ biến nhất có thể được phân loại theo cách tiếp cận đơn giản hóa trong kiểm soát áp suất, kiểm soát thể tích và hỗ trợ áp lực (Bảng 4 và 5). Các chế độ này có thể được chia thành kiểm soát hỗ trợ, thông khí bắt buộc gián đoạn đồng bộ (SIMV) và thông khí tự phát (Hình 5). Đặc điểm nổi bật của kiểm soát hỗ trợ là nỗ lực tự phát của bệnh nhân dẫn đến việc cung cấp một nhịp thở giống hệt như nhịp thở bắt buộc (cùng một Vt hoặc áp lực đẩy, cùng một kiểu thời gian / kiểu dòng) (Hình 5). Ngược lại, trong SIMV, các cài đặt do bác sĩ lâm sàng này chỉ áp dụng cho hơi thở bắt buộc, trong khi hơi thở tự nhiên khác nhau bằng cách hoàn toàn được bắt đầu và chấm dứt bởi nỗ lực tự phát của bệnh nhân với bất kỳ thể tích, áp lực hoặc lưu lượng nào mà bệnh nhân có thể tác động mà không cần bất kỳ sự trợ giúp nào của máy thở. SIMV là một hình thức thông khí bắt buộc không liên tục. Ở chế độ thông khí tự phát, bác sĩ lâm sàng cài đặt FIO2, PEEP và hỗ trợ thể tích hoặc áp lực, nhưng không cài đặt tần số thở, thời gian hô hấp hoặc mô hình dòng khí (kiểu dòng), vì vậy bệnh nhân phải bắt đầu nhịp thở. Thêm một chế độ, thông khí giải phóng áp lực đường thở (APRV), là chế độ thông khí kiểm soát áp suất được sử dụng ở những bệnh nhân bị giảm oxi máu kháng trị. APRV có pha hít vào kéo dài trong thông khí có tỷ lệ đảo ngược, trong đó nhịp thở tự nhiên không hạn chế có thể xảy ra bất cứ lúc nào (43).
Không có chế độ máy thở nào là tối ưu cho tất cả bệnh nhân tim. Tuy nhiên, các chế độ cho phép thở hoàn toàn tự nhiên mà không cần hỗ trợ máy thở (ví dụ: SIMV) có thể tăng mức tiêu thụ oxy và cơ tim khi một số hơi thở tự nhiên không được hỗ trợ đầy đủ, có thể dẫn đến mất đồng bộ giữa bệnh nhân và máy thở. Các chế độ như vậy có thể không tối ưu cho bệnh nhân tim bị sốc tim hoặc thiếu máu cơ tim (44 - 46). Tìm mức hỗ trợ phù hợp giảm nhẹ mệt mỏi cơ hoành và tránh teo cơ hoành, cả hai đều có thể làm tăng thời gian thở máy (47). Mặc dù không có chiến lược nào đã được chứng minh để ngăn ngừa rối loạn chức năng cơ hoành, sử dụng các cài đặt hỗ trợ tối thiểu cần thiết là hợp lý.
Sau khi chọn chế độ máy thở, bác sĩ lâm sàng phải thiết lập các thông số riêng lẻ (Hình 5, Bảng 4 trực tuyến). FiO2 và PEEP có tác dụng vượt trội đối với quá trình oxy hóa và cần được điều chỉnh để đạt được độ bão hòa oxy chấp nhận được (SaO2), với sự điều chỉnh giảm xuống sớm của FiO2 để giảm thiểu nguy cơ nhiễm độc oxy. PEEP thường được đặt ở mức 5 cmH2O và có thể được điều chỉnh theo mức SaO2 mong muốn trong khi xem xét ảnh hưởng của PEEP quá mức (ví dụ, giảm tiền tải, chấn thương khí áp) và các PEEP rất thấp không phù hợp (ví dụ, chấn thương do xẹp phổi) cũng như các hiệu ứng lên trên RV và LV.
Tác động của Vt và tần số thở (thông khí phút) chủ yếu ảnh hưởng đến PCO2 và pH. Vt nên được cài đặt không vượt quá 6 - 10 ml / kg (6 đến 8 ml / kg trọng lượng cơ thể lý tưởng cho ARDS), trong khi giữ Pplat < 30 cmH2O để giảm thiểu nguy cơ căn dãn quá mức phế nang. Mặc dù thông khí với Vt thấp đã được nghiên cứu chủ yếu ở ARDS, nhưng tình trạng quá liều từ thông khí Vt cao cũng có thể gây hại ở bệnh nhân tim theo 1 nghiên cứu, cho thấy Vt > 9,3 ml / kg trọng lượng cơ thể lý tưởng có liên quan đến kết quả bất lợi ở CICU (48 ). Vt cao không thích hợp có thể gây ra tình trạng "chấn thương thể tích" từ việc căn dãn quá mức, nhưng Vt thấp không phù hợp có thể gây ra tình trạng xẹp phổi, mất đồng bộ máy thở của bệnh nhân và trao đổi khí dưới mức tối ưu.
Nhịp thở có thể được điều chỉnh để đạt được PCO2 và pH chấp nhận được cho nhu cầu bệnh nhân (ví dụ, tăng CO2 cho phép đối với tình trạng thiếu oxy kháng trị trong ARDS có thể phù hợp, trong khi hạn chế nhiễm toan và tăng CO2 có lợi ở bệnh nhân rối loạn chức năng RV). Điều quan trọng là nhấn mạnh rằng dữ liệu từ các nghiên cứu trong các hội chứng phổi có thể không được ngoại suy cho tất cả các bệnh nhân tim, nhấn mạnh sự cần thiết phải nghiên cứu được thực hiện cụ thể trong các đơn vị CICU.
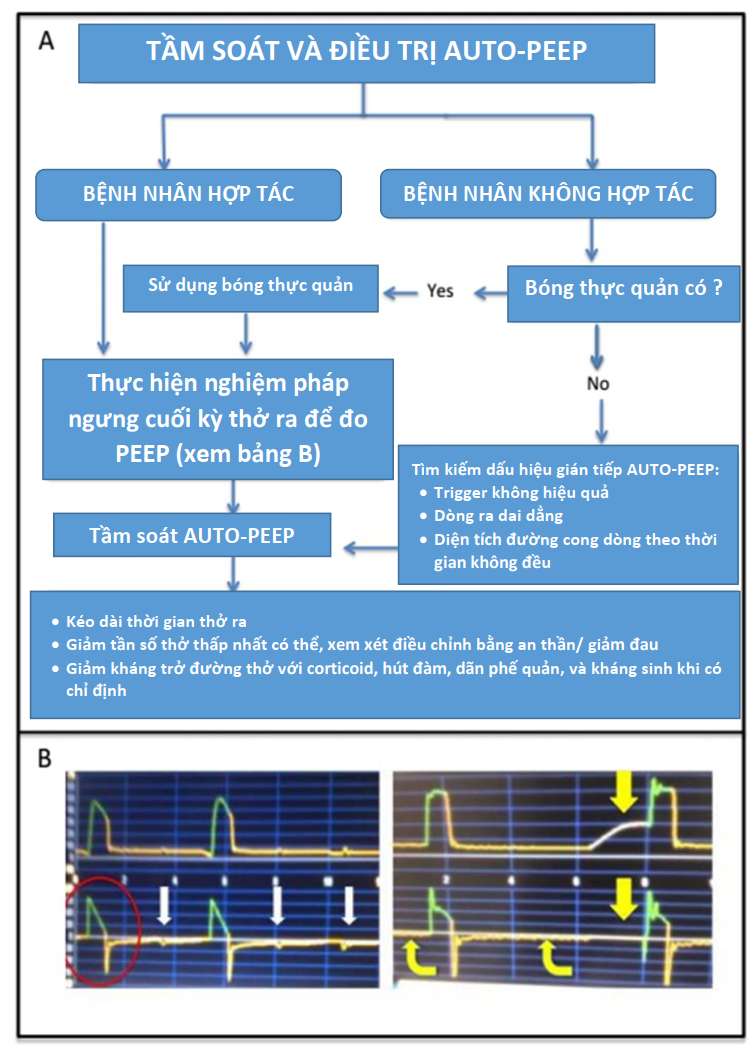
Mỗi cài đặt máy thở có cả lợi ích như dự định và hậu quả bất lợi tiềm ẩn; do đó, để đánh giá phản ứng của bệnh nhân với IM-PPV và nguy cơ biến chứng, bác sĩ lâm sàng phải theo dõi huyết động, khí máu, Vt, thông khí phút, Pplat, PEEP nội sinh và tương tác của bệnh nhân-máy thở. Bác sĩ lâm sàng cần phải tỉ mỉ trong việc tránh PEEP nội sinh bằng cách cho phép thời gian thở ra đầy đủ hoặc bằng cách điều chỉnh đường cong dòng chảy và vận tốc dòng thở. PEEP nội sinh có thể dẫn đến bẫy không khí lũy tiến và có thể ảnh hưởng đến tiền tải nếu không được phát hiện và giải quyết (Hình 6).
|
BẢNG 5 Ưu điểm và nhược điểm của Chế độ PS |
|
|
Thông khí hỗ trợ áp lực (PS) |
|
|
Thuận lợi |
Bất lợi |
|
Bệnh nhân có thể kiểm soát độ sâu, thời gian và lưu lượng của từng hơi thở Cho phép linh hoạt trong hỗ trợ máy thở Cải thiện đồng bộ với máy thở và công cơ hoành |
Mức hỗ trợ quá mức có thể dẫn đến: Nhiễm kiềm hô hấp Tăng bơm khí quá mức Kích hoạt không hiệu quả Không nói được Hỗ trợ dưới mức tối ưu có thể dẫn đến: Mệt mỏi cơ hoành Nhiễm toan hô hấp |
ÁP DỤNG THÔNG KHÍ ÁP LỰC DƯƠNG Ở BỆNH NHÂN TIM MẠCH
NI-PPV TRONG PHÙ PHỔI DO TIM.
Trong số các tình trạng tim nghiêm trọng, CPE biến chứng từ 15% đến 40% nhập viện của HF. Thông thường, chỉ oxy bổ sung là không đủ cho CPE và cần có hỗ trợ nâng cao hơn với NI-PPV. Thông qua các cơ chế đã được mô tả trong tổng quan này, NI-PPV làm tăng áp lực trong khoang ngực, giảm tiền tải RV và LV và hậu tải LV (5,49), cải thiện chứng khó thở và tăng cường oxy hóa (41,50,51). Hơn nữa, các bệnh viện sử dụng NI-PPV có tỷ lệ đặt nội khí quản thấp hơn (52).
3CPO (Ba can thiệp trong phù phổi do tim) (41) là một thử nghiệm đa trung tâm, ngẫu nhiên, có đối chứng so sánh CPAP (n = 346) và BiPAP (n = 356) với liệu pháp oxy tiêu chuẩn (n = 367) ở bệnh nhân mắc CPE (phù phổi do tim). Sau 7 ngày, không có sự khác biệt về kết cục chính của tỷ lệ tử vong khi so sánh NI-PPV với liệu pháp oxy tiêu chuẩn (9,5% so với 9,8%; p 0,87). Hơn nữa, không có sự khác biệt về điểm cuối kết hợp của tử vong hoặc tỷ lệ đặt nội khí quản giữa các loại NI-PPV. Tuy nhiên, lúc 1 giờ, đã có những cải thiện đáng kể về khó thở, nhịp tim, nhiễm toan và chứng tăng huyết áp với NI-PPV (41). Nghiên cứu này bị hạn chế bởi tỷ lệ đặt nội khí quản và tỷ lệ tử vong thấp, và sự giao thoa đáng kể giữa các nhóm. Ngược lại, 2 phân tích gộp tiếp theo báo cáo giảm tỷ lệ tử vong trong bệnh viện và đặt nội khí quản bằng NI-PPV trong CPE (53,54), nhưng hầu hết các thử nghiệm bao gồm đều nhỏ, chất lượng thấp hơn và với định nghĩa khác nhau và mức độ nghiêm trọng của CPE.
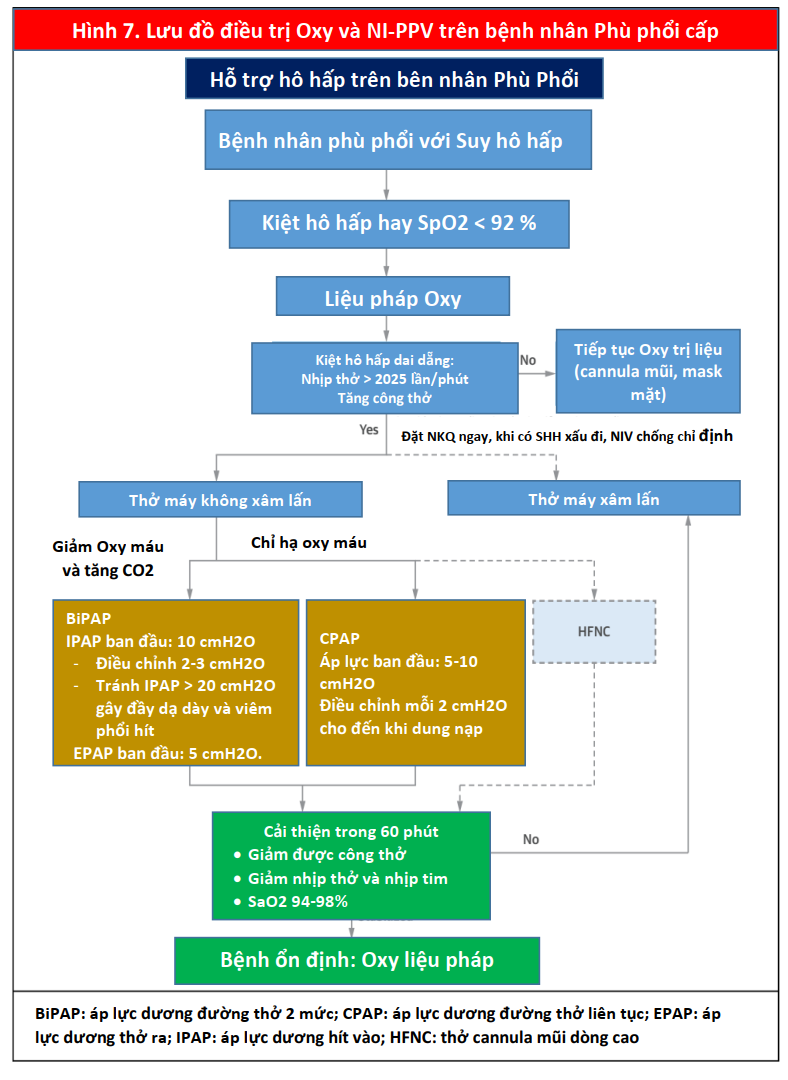
Sau khi quyết định sử dụng NI-PPV được đưa ra, cần đưa ra quyết định càng sớm càng tốt (Hình 7) (55). CPAP hoặc BiPAP là lựa chọn đầu tiên hợp lý cho bệnh nhân mắc CPE. Ở bệnh nhân nhiễm toan, tăng CO2 máu hoặc COPD đồng mắc, BiPAP được ưu tiên làm phương thức ban đầu. Nếu NI-PPV sẽ thành công, bệnh nhân thường sẽ cho thấy sự cải thiện về nhịp thở và nhịp tim, công thở và trao đổi khí trong w60 phút (56). Nếu bệnh nhân tiếp tục xấu đi, phải đặt nội khí quản ngay lập tức.
IM-PPV Ở BỆNH NHÂN SUY THẤT TRÁI VÀ CHOÁNG TIM.

|
Bảng 6. Ảnh hưởng của 1 số thuốc then chốt trong PPV tại CICU |
||||
|
Thuốc |
Liều |
Dược lý |
Tác động lên TM |
Bình luận |
|
An thần/ các thuốc khởi mê |
Tất cả có thể có tác động xấu lên Tim mạch |
|||
|
Propofol |
Bolus: 0,25-2 mg/kg Truyền: 5-50 mcg/kg/phút |
Mê toàn thân |
Tụt huyết áp Nhịp chậm |
Tăng HA/ nhịp nhanh có thể Cẩn thận EF < 50% Ức chế cơ tim khi bolus Hội chứng truyền Propofol kéo dài |
|
Etomidate |
0,3-0,4 mg/kg |
Mê toàn thân |
Tụt HA đo ức chế thượng thận |
Một liều corticoid cho 6-24h Gây suy thượng thận Sử dụng đặt NKQ/ suy RV Tăng tử vong/ sepsis |
|
Dexmedet -omidine |
Tải: 1mg/kg trong 10 phút Truyền: 0,2-0,7 mg/kg/h |
Đối vận α2 An thần |
Tụt HA Nhịp chậm |
Tụt HA do ức chế tim Tăng HA do ức chế α2 Tăng HA và nhịp nhanh khi giảm liều Cẩn thận với block tim |
|
Methohexital |
Tải: 0,75-1 mg/kg |
Mê toàn thân |
Tụt HA Nhịp nhanh |
Tụt HA do ức chế tim và nhịp nhanh |
|
Ketamine |
Tải: 0,1-0,5 mg/kg Truyền: 5-20 mcg/kg/phút |
Mê toàn thân |
Tăng HA Nhịp nhanh |
Tụt HA có thể Cẩn thận với CAD, thiếu hụt cathecholamine Ít tụt HA do tăng SVR Dùng đặt NKQ/ suy RV không có thiếu hụt cathecholamine |
|
Các thuốc ức chế thần kinh cơ |
Đảm bảo an thần và giảm đau đủ, theo dõi NMB với kích thích thần kinh ngoại biên. |
|||
|
Succinylcholin |
Bolus: 1-2mg/kg |
Ức chế thần kinh cơ phân cực |
Nhịp chậm (trẻ em) Tăng HA, nhịp nhanh RLN do tăng Kali |
Tránh rối loạn điện giải: tăng kali máu Bệnh nhược cơ Rối loạn men giả Cholinesterase |
|
Rocuronium |
Tải: 0,6-1,2 mg/kg Truyền: 4-16 mcg/kg/phút |
Không phân cực |
< 1% Phản vệ Tăng HA Nhịp nhanh |
Cẩn thận với với bệnh hay dùng chất đối kháng NMB mạnh Dùng bolus trong phòng mổ |
|
Vecuronium |
Bolus: 0,08-0,1 mg/kg Truyền: 1 mcg/kh/phút |
Không phân cực |
Phản vệ. Tụt HA. Nhịp chậm Đáp ứng chéo với NMBs khác |
Cẩn thận với với bệnh hay dùng chất đối kháng NMB mạnh. Dùng bolus trong phòng mổ |
|
Cisatracurium |
Bolus: 0,15-0,2 mg/kg Truyền: 0,5-10 mcg/kh/phút |
Không phân cực |
< 1% Phản vệ. Tụt HA Nhịp chậm Đáp ứng chéo với NMBs khác |
Cẩn thận với với bệnh hay dùng chất đối kháng NMB mạnh. Dùng bolus trong phòng mổ |
|
Các thuốc đảo ngược tình trạng phong bế thần kinh cơ và Opiod |
|
|||
|
Sugammadex |
Bolus: 2-16 mg/kg tùy thuộc mức độ block |
Đảo ngược ức chế thần kinh cơ |
Chủ yếu phản vệ Tụt HA Tăng HA Nhịp nhanh và nhịp chậm QT kéo dài |
Chỉ đảo ngược Rocuronium, Vecuronium và Succinylcholin |
|
Naloxone |
Bolus: 0,4-2mg, có thể lặp lại đến 10mg |
Đối kháng Opiod |
Đỏ mặt Tăng HA Tụt HA Rối loạn nhịp |
Sử dụng Opiod mãn: giảm liều và pha loãng NS 10ml Truyền chậm, tránh hội chứng cai cấp Phóng thích Cathecholamin; cẩn thận cho bệnh nhân tim |
|
Giảm đau |
|
|||
|
Fentanyl |
B: 25-75 mg/ 1-2h I: 50-100 mcg/h |
Giảm đau, mê toàn thân |
Tụt HA Nhịp chậm |
Hội chứng co cứng thành ngực do fentanyl |
|
Hydro- -morphone |
B: 0,2-0,6 mg/ 1-2h I: 0,3 – 5 mg/h |
Opiod Giảm đau |
Tụt HA, nhịp chậm Tăng HA, nhịp nhanh |
Liều thay đổi phụ thuộc đường dùng |
|
Morphine |
B: 2-5 mg/ 4h I: 2 – 30 mg/h |
Opiod Giảm đau |
Nhịp nhanh Nhịp chậm Tụt HA Phóng thích Histamin |
Liều thay đổi phụ thuộc đường dùng Dãn tĩnh mạch cho nên cẩn thận “tình trạng phụ thuộc tiền tải” (suy RV…) |
|
An thần |
|
|||
|
Midazolam |
B: 0,01-0,05mg/kg I: 0,02 -0,1 mg/kg/h |
An thần Ngủ Chống co giật |
Tụt HA |
|
|
Lo âu, sảng, kích động |
|
|||
|
Haloperidol |
B: 0,5-10mg/ 4h I: 0,5 – 2 mg/h |
Chống loạn thần điển hình |
Tụt HA Rối loạn nhịp |
QT kéo dài |
Có tới 80% bệnh nhân bị sốc tim (57 - 59) bị suy hô hấp. Như đã mô tả trong tổng quan này (xem phần Cơ chế phổi của PPV), IM-PPV với PEEP có tác dụng thuận lợi đối với huyết động học ở bệnh nhân HF (Bảng 2). Những tác động này bao gồm giảm hậu tải LV sau khi giảm áp lực xuyên ngực và xuyên phổi (60); cải thiện xung huyết và giảm tải LV bằng cách giảm tiền tải (61); tối ưu hóa tưới máu cơ tim LV và RV và làm giảm thiếu máu cục bộ bằng cách cung cấp oxy tốt hơn, đảo ngược tình trạng co mạch phổi do thiếu oxy và giảm công thở; và cải thiện hình học LV và MR chức năng liên quan (18,19,62). Thông qua các hiệu ứng này trên tiền tải và hậu tải, PEEP cải thiện tình trạng phù phế nang và kẽ. Một lượt đồ ví dụ để thực hiện IM-PPV ở bệnh nhân suy tim hoặc sốc được thể hiện trong Hình 8.
Mặc dù có những lợi ích này, vẫn có những lo ngại về tác động bất lợi tiềm tàng của PEEP ở bệnh nhân rối loạn chức năng LV, dẫn đến giảm CO do giảm tiền tải RV và tăng hậu tải(16). Tuy nhiên, các nghiên cứu in vivo không hỗ trợ mối quan tâm này, đặc biệt là khi chức năng RV và trạng thái thể tích bình thường (63,64). Do đó, trong thực hành, nó xuất hiện có liên quan để phân biệt tác dụng sinh lý của PEEP trong tâm thất bình thường và suy. LV bình thường phụ thuộc vào tiền tải và nhạy cảm hơn với việc giảm hồi lưu tĩnh mạch với PEEP. Ngược lại, ở những bệnh nhân có LV giãn nở và hạ huyết áp phụ thuộc vào hậu tải, PEEP sẽ giảm tiền tải và sung huyết và sẽ thúc đẩy dòng chảy về phía trước (65). Ở những bệnh nhân bị tăng áp lực mao mạch phổi (PCWP), CO cải thiện khi PEEP tăng (từ 0 đến 8 cmH2O) (66); tuy nhiên, ở những bệnh nhân có áp lực mao mạch phổi bít bình thường hoặc thấp, PEEP có thể giảm thấp CO (61,67). Do đó, ở những bệnh nhân bị sốc tim rõ ràng với áp lực đổ đầy cao và sức cản mạch máu hệ thống cao, PEEP có thể mang lại lợi ích nếu RV không bị tổn thương và bệnh nhân không bị giảm thể tích máu (Hình 8).
IM-PPV Ở BỆNH NHÂN SUY THẤT PHẢI.
Việc kiểm soát suy hô hấp bằng IM-PPV ở bệnh nhân suy RV đặc biệt khó khăn (27). IM-PPV nên tránh khi có thể hoặc sử dụng thận trọng ở những bệnh nhân này vì nguy cơ ảnh hưởng huyết động bất lợi (68,69). Đồng thời mất trương lực giao cảm với thuốc an thần và giảm huy động phế nang từ việc giảm thông khí do mất trương lực của trung khu hô hấp có thể góp phần vào sự xuất hiện tụt huyết áp mà bác sĩ phải cẩn thận lường trước. Khi đặt nội khí quản là cần thiết, tiền tải và áp lực động mạch trung bình phải được tối ưu hóa trước khi gây mê cho bệnh nhân để đặt nội khí quản. Sau khi tối ưu hóa thể tích, nên sử dụng thuốc vận mạch và, nếu cần thiết, nên sử dụng thuốc giãn mạch phổi để duy trì áp lực động mạch trung bình trên áp lực động mạch phổi trung bình (lý tưởng là trên 60 mm Hg). Ngoài ra, nên tham khảo ý kiến bác sĩ gây mê tim để đặt nội khí quản nếu thời gian cho phép. Các tác nhân gây mê được ưu tiên là những tác nhân ít ảnh hưởng tiêu cực đến trương lực cơ và trương lực mạch máu, chẳng hạn như ketamine hoặc etomidate (Bảng 6). Tuy nhiên, nên tránh dùng ketamine ở những bệnh nhân có khả năng bù trừ giao cảm kém vì các đặc tính tăng co bóp âm tính của nó vẫn có thể dẫn đến phản ứng hạ huyết áp. Sau khi đặt nội khí quản, sự chú ý liên tục để duy trì tiền tải đầy đủ là rất quan trọng (20,27).
Trong IM-PPV ở bệnh nhân suy RV, thể tích thông khí thấp và cao (chọn lọc và quá mức) (Hình 4), Pplat cao, thiếu oxy và (70), cũng như PEEP cao đều có thể làm tăng hậu tải RV. Trong suy RV, các chiến lược máy thở nên nhằm mục đích đạt được huy động phế nang, đồng thời hạn chế tình trạng căng dãn quá mức. Các mục tiêu cụ thể khác của IMPPV trong quần thể bệnh nhân này bao gồm cải thiện oxy hóa, tránh tăng CO2 máu và nói chung sử dụng thể tích thông khí thấp đến trung bình (ví dụ, 8 ml / kg trọng lượng cơ thể lý tưởng), trong khi duy trì Pplat <30 cmH20 và giảm thiểu PEEP (cài đặt ban đầu từ 3 đến 5 cmH2O nếu bệnh nhân bị sốc tim [64] và <12 cmH2O nếu bệnh nhân không bị sốc [71,72]). Khi nhiễm toan làm tăng PVR, việc duy trì PaCO2 <60 mmHg sẽ cải thiện PVR, ngay cả khi nguyên nhân của nhiễm toan là chuyển hóa (73) (Hình 8). Là một chủ đề nâng cao, việc đánh giá một loạt các đường cong áp suất / thể tích và chỉ số căng (tỷ lệ huy động/ tăng bơm của phổi ở các điểm áp suất / thời gian khác nhau) trong máy thở có thể giúp bác sĩ lâm sàng đạt được các mục tiêu này và điều chỉnh IM-PPV chiến lược cho bệnh nhân (74,75).
Các phương pháp tiếp cận nâng cao đối với IM-PPV có thể được xem xét đối với một số bệnh nhân bị suy RV, bao gồm APRV, thông khí dao động tần số cao (HFOV) và thông khí nằm sấp (xem phần Quản lý điều trị giảm oxy máu). Mặc dù việc sử dụng thông khí nằm sấp dễ dàng có thể cải thiện PVR, huyết động của RV và oxy hóa (76), bằng chứng ủng hộ phương pháp này, cũng như APRV và HFOV, bị giới hạn trong các nghiên cứu tiền lâm sàng và loạt nhỏ (17,73,76,77).
CÁC TÌNH TRẠNG PHỤ THUỘC TIỀN TẢI KHÁC: CHÈN ÉP TIM CẤP VÀ VIÊM MÀNG TIM CO THẮT.
Trong số những bệnh nhân bị tamponade, nói chung, IM-PPV nên được dành riêng cho những bệnh nhân không ổn định, mất khả năng bảo vệ đường thở hoặc đang phải can thiệp phẫu thuật. Do sự phụ thuộc tiền tải và nhịp tim nhanh bù ở bệnh nhân bị tamponade và co thắt màng tim, PPV và an thần liên quan có thể làm thúc đẩy sự sụp đổ huyết động. Do đó, NI-PPV có thể thích hợp hơn, hạn chế PEEP. Hơn nữa, tối ưu hóa tiền tải là rất quan trọng. Ở những bệnh nhân đặt nội khí quản là lựa chọn duy nhất, kỹ thuật đặt nội khí quản có thể được xem xét với thuốc vận mạch sẵn sàng và có khả năng thực hiện phẫu thuật dẫn lưu màng tim hoặc mở cửa sổ màng tim nếu xảy ra sụp đổ tim. Nên sử dụng PEEP rất thấp (0 đến 3 cmH2O) để tránh ảnh hưởng đến hồi lưu tĩnh mạch, cho đến khi dịch màng tim đã được rút hết (78).
HỖ TRỢ MÀNG NGOÀI CƠ THỂ TRONG LÚC IM-PPV.
Sốc tim là một trong những chỉ định phát triển nhanh nhất đối với ECMO ở người trưởng thành (79). ECMO tĩnh mạch - động mạch cung cấp cả hỗ trợ tuần hoàn 2 thất và hô hấp (80). Sau khi rút máu tĩnh mạch thông qua dẫn lưu ống thông, máu khử oxy đi qua máy tạo oxy trước khi trở lại hệ thống động mạch (81). Trao đổi khí thông qua ECMO cho phép bác sĩ lâm sàng lựa chọn "cài đặt nghỉ ngơi" trên máy tính để giảm thiểu tổn thương phổi do thở máy (VALI). Mặc dù sự khác biệt lớn trong thực tế tồn tại và hướng dẫn lâm sàng hạn chế (82), hầu hết các chuyên gia ủng hộ thể tích thông khí thấp (4 đến 6 ml / kg trọng lượng cơ thể lý tưởng), nhịp thở thấp (5 đến 10 nhịp thở / phút), cho phép nhịp thở tự phát nếu có thể, PEEP # 10 cmH2O, Pplat <25 cmH20 và FiO2 dung nạp thấp nhất (81.83). Nhiều trung tâm sử dụng thông khí kiểm soát áp lực dựa trên protocol từ thử nghiệm CESAR (Đánh giá hiệu quả và kinh tế của hỗ trợ thông khí thông thường so với màng trao đổi oxi ngoài cơ thể cho suy hô hấp nghiêm trọng ở người lớn) (82.84). Tuy nhiên, những người khác ủng hộ thông khí kiểm soát thể tích (82). Chiến lược thông khí ở bệnh nhân dùng ECMO vẫn là một lĩnh vực quan trọng cho nghiên cứu trong tương lai.
ẢNH HƯỞNG LÊN TIM CỦA CÁC THUỐC AN THẦN, GIẢM ĐAU, ỨC CHẾ THẦN KINH CƠ, CHỐNG LO ÂU.
Các bác sĩ thực hành tim mạch nên nhận thức được nhiều tác dụng tim mạch có liên quan của nhiều thuốc cần thiết cho việc chăm sóc hồi sức tổng quát trong CICU, cũng như vai trò trung tâm của quản lý thuốc về đau và sảng trong việc đạt được hiệu quả IM-PPV và rút ống thành công. Dữ liệu quan sát cho thấy rằng sự tham gia của dược sĩ hồi sức trong các vòng ICU có thể làm giảm các tác dụng phụ của thuốc, kê đơn sai sót và tăng cường lựa chọn điều trị (85,86). Nhiều loại thuốc, bao gồm thuốc giảm đau gây nghiện, dexmedetomidine và propofol, có thể gây hạ huyết áp và nhịp tim chậm thông qua các cơ chế khác nhau (Bảng 6). Hướng dẫn quản lý đau, kích động, mê sảng và phong tỏa thần kinh cơ phải luôn có sẵn (87,88).
QUẢN LÝ GIẢM OXI MÁU NẶNG
Khi bệnh nhân không đáp ứng với các chiến lược thông khí đã được mô tả, các liệu pháp cứu vãn có sẵn bao gồm thao tác huy động, chiến lược thông khí tiên tiến, sử dụng ức chế thần kinh cơ để cải thiện đồng bộ thông khí, thông khí nằm sắp, thuốc giãn mạch và ECMO. Những chiến lược này đã được nghiên cứu chủ yếu trong ARDS; tuy nhiên, chúng có liên quan ngày càng tăng đối với bệnh nhân phổ rộng được chăm sóc ở một số CICU nâng cao.
Vùng phổi phụ thuộc được tưới máu nhưng có thể có thông khí không đầy đủ. Thao tác huy động phổi dựa trên việc tăng PEEP thoáng qua lên cao hơn bình thường để cải thiện quá trình oxy hóa và giảm VALI. Mặc dù các thử nghiệm lâm sàng sớm và phân tích tổng hợp cho thấy không có hại từ các thao tác huy động, một thử nghiệm lâm sàng gần đây cho thấy rằng việc điều trị huy động phổi và điều chỉnh PEEP tiến triển có thể liên quan đến tác hại (13,89 .91).
Dữ liệu sống còn cho các chế độ thông khí khác như HFOV hoặc APRV còn thiếu. HFOV cải thiện quá trình oxy hóa, nhưng không cải thiện khả năng sống sót và có liên quan đến tác hại trong một thử nghiệm (92 - 94).
Trong thử nghiệm lâm sàng trên 340 đối tượng, ức chế thần kinh cơ trong 48 giờ đã ngăn ngừa mất đồng bộ máy thở và tổn thương phổi và giảm 90 ngày tử vong (95). Mặc dù mê sảng và bệnh lý thần kinh liên quan bệnh nặng là mối quan tâm, sử dụng ngắn hạn ức chế thần kinh cơ không liên quan đến tình trạng tăng yếu cơ (95). Khi ức chế thần kinh cơ được chỉ định, đủ thuốc an thần và giảm đau là điều cần thiết để tránh cảm nhận tàn bạo (87).
Thông khí nằm sắp đã được ủng hộ trong tình trạng thiếu oxy nghiêm trọng để cải thiện kết quả thông qua cách huy động phổi và giảm sự mất tương hợp thông khí-tưới máu. Các thử nghiệm lâm sàng sớm không chứng minh được lợi ích trong một thời gian ngắn của việc nằm sắp, nhưng trong một thử nghiệm tiếp theo, nằm sắp ít nhất 16 giờ mỗi ngày giảm tỷ lệ tử vong (96 - 98). Thông khí này có vẻ hiệu quả hơn nếu được bắt đầu trong vòng 3 ngày sau khi bị suy hô hấp và ít hữu ích hơn sau 7 ngày (99).
Thuốc giãn mạch, như oxit nitric dạng hít và epoprostenol dạng hít, đã được sử dụng trong tình trạng thiếu oxy nghiêm trọng để cải thiện tình trạng không thông khí-tưới máu và để giảm áp lực động mạch phổi với cải thiện thoáng qua trong oxy hóa, nhưng không làm giảm tỷ lệ tử vong. Thuốc giãn mạch phổi dạng hít có thể được sử dụng như một liệu pháp cứu nguy cho bệnh tăng áp phổi liên quan đến tình trạng thiếu oxy nặng làm cầu nối cho các phương pháp điều trị khác (100-102). Tuy nhiên, thuốc giãn mạch phổi có thể thúc đẩy phù phổi ở bệnh nhân có hiệu suất LV kém và áp lực làm đầy cao, do lưu lượng máu lên phổi tăng đột ngột. Oxit nitric có thể liên quan đến sự phát triển của rối loạn chức năng thận (103) và methemoglobin máu (104).
CÁC BIẾN CHỨNG CHÍNH CỦA IM-PPV
Cùng với việc tránh các tác động huyết động nghiêm trọng của IMPPV được mô tả trong phần trước đó, bác sĩ lâm sàng CICU cần lưu ý các biến chứng quan trọng khác của IM-PPV và các chiến lược để ngăn chặn chúng. VALI (tổn thương phổi liên quan đến thở máy) và viêm phổi liên quan đến máy thở (VAP) là các biến chứng thường xuyên và có khả năng phòng ngừa được liên quan đến tỷ lệ mắc bệnh và tử vong đáng kể.
Mặc dù phổ biến hơn ở những bệnh nhân mắc ARDS, VALI đã được ước tính xảy ra ở > 25% bệnh nhân thở máy không có ARDS. Dạng VALI được nhận ra trên lâm sàng nhất là các chấn thương khí áp (tràn khí màng phổi và tràn khí trung thất, tràn khí ổ bụng), nhưng nó cũng bao gồm chấn thương thể tích, chấn thương do xẹp phổi, chấn thương sinh học (phản ứng viêm) và độc tính oxy (105). Không giống như trong ARDS, không có mục tiêu Vt được xác định cho bệnh nhân bệnh nặng thở máy mà không bị tổn thương phổi (106). Một số nghiên cứu, bao gồm các phân tích tổng hợp, đã gợi ý rằng Vt thấp hơn có liên quan đến việc giảm tỷ lệ nhiễm trùng phổi, ARDS và tử vong (106.107). Tuy nhiên, những nghiên cứu này bị hạn chế do thiếu một tiêu chuẩn của nhóm đối chứng. Ngoài việc dung nạp chứng tăng CO2 máu và thể tích thông khí hơn, nên tránh căng dãn phế nang với Pplat <30 cmH2O. Giảm thiểu áp lực đẩy ("P delta": Pplat - PEEP) (Hình 2) có thể phù hợp hơn Vt thấp để cải thiện kết quả trong ARDS (108).
Tuy nhiên, thông khí ở thể tích phổi thấp có thể dẫn đến việc huy động liên tục và mất huy động các đơn vị phế nang dẫn đến các lực căng xé và chấn thương do xẹp phổi (105). Trên lâm sàng, chấn thương do xẹp phổi có thể khó phát hiện và thường yêu cầu đánh giá các vòng thể tích - áp lực với thuốc an thần nặng hoặc dãn cơ thần kinh cơ (109). Việc phòng ngừa chấn thương do xẹp phổi được thực hiện bằng PEEP và trong một số tình huống lâm sàng nhất định (ví dụ: chăm sóc phẫu thuật), bằng các thao tác huy động định kỳ, trong khi vai trò của nó trong các điều kiện khác như ARDS chưa rõ ràng. Việc đặt bóng thực quản để đo chính xác hơn áp lực xuyên phổi và compliance phổi có thể hữu ích (110).
VAP có liên quan đến sự gia tăng đáng kể về tỷ lệ mắc bệnh, tỷ lệ tử vong và chi phí của bệnh nhân (111). Mặc dù bằng chứng còn hạn chế, tỷ lệ mắc VAP trong CICU dường như cao hoặc cao hơn các ICU khác (112). Các biện pháp đơn giản có hiệu quả về chi phí được thực hiện để giảm VAP bao gồm nâng cao đầu giường > 30 độ, an thần nhắm mục tiêu, thử nghiệm thức tỉnh tự phát hàng ngày có hoặc không có thử nghiệm thở tự nhiên (SBT) để giảm thiểu ngày thở máy, duy trì đúng dây máy thở và vận động sớm (113,114). Kết hợp các chiến lược này với chlorhexidine vệ sinh đường miệng cũng đã làm giảm VAP (115). Dấn lưu hồ chứa dưới nấp thanh môn và trên bóng chèn NKQ cũng có thể làm giảm thời gian lưu lại ICU và thời gian IM-PPV, và hạn chế VAP (116).
CÁC NGUYÊN TẮC GIẢI PHÓNG KHỎI IM-PPV
Can thiệp hiệu quả nhất để giảm các biến chứng là giải phóng sớm khỏi IM-PPV. Với thời gian IM-PPV tăng, các biến chứng, tỷ lệ tử vong và chi phí điều tăng (117). Tuy nhiên, những bệnh nhân thất bại rút ống NKQ sau khi dung nạp SBT cho thấy tăng nguy cơ biến chứng và tử vong so với những bệnh nhân tương tự được rút ống thành công (118).
IM-PPV và thuốc giảm đau và thuốc an thần liên quan thường làm giảm huyết áp, nhịp tim, công cơ tim và tiêu thụ oxy. Giải phóng khỏi IMPPV sẽ loại bỏ các tác động này và do đó, có thể thúc đẩy các hậu quả bất lợi ở bệnh nhân tim, bao gồm cả "phù phổi do máy thở"(119). Hướng dẫn chuyên môn để giải phóng khỏi máy thở nhắm SBT với thúc đẩy lực hít vào, giảm thiểu thuốc an thần, vận động sớm và bệnh nhân có nguy cao rút NKQ thất bại với NI-PPV hoặc HFNC (120.121).
Đánh giá sự sẵn sàng cho rút ống bao gồm xác định liệu nguyên nhân gây suy hô hấp đã được giảm nhẹ, ổn định về điện học hay huyết động và bệnh nhân có thể hợp tác hay không. Thứ hai, SBT có thể được thử với hỗ trợ áp lực (ví dụ: 5 cmH20) để vượt qua sức cản của ống nội khí quản và thường được ưu tiên hơn so với T-tube hoặc CPAP đơn thuần. Mặc dù SBT thành công chỉ với T-tube hoặc CPAP có thể dự đoán thành công rút ống, chiến lược này có thể làm tăng mức tiêu thụ oxy của cơ tim và tốt nhất có thể tránh được ở những bệnh nhân bị suy giảm chức năng tâm thất, bệnh tim thiếu máu cục bộ hoặc trong các tình huống tăng tải sau đó là bất lợi (ví dụ: trào ngược van nặng) (44.122) (riêng với kiến thức có được từ y văn khác, bản thân ND nhận thấy T-tube có hiệu quả hơn vì nó bộc lộ rõ nhưng bệnh nhân nào cần phải đánh giá kỹ hơn hay phải trải qua điều trị tích cực hơn các vấn đề tim mạch só với SBT thông qua hỗ trợ áp lực thấp). Các dự báo rút ống thành công, chẳng hạn như chỉ số thở nông nhanh (nhịp thở / TV tính bằng lít) # 105, lực hít vô âm <30 cmH2O, ho mạnh hoặc sự hiện diện của rò rỉ qua cuff đều không hoàn hảo nhưng có thể bổ sung đánh giá lâm sàng chung (123).
Việc thất bại giải phóng khỏi IM-PPV nên được nghi ngờ chứng "phù phổi do cai máy" (124). Cần xem xét lại tình trạng quá tải thể tích kéo dài, thiếu máu cơ tim, rối loạn chức năng tâm trương hoặc thoái hóa van hai lá. Tiền tải, sức co bóp và tối ưu hóa hậu tải có thể thành công trong việc quản lý vấn đề này. Cuối cùng, điều quan trọng là phải xem xét thời gian rút ống liên quan đến việc rút bỏ hỗ trợ cơ học, đặc biệt là các ống thông tại đùi, để đầu có thể được nâng lên trong giai đoạn sau rút ống ngay lập tức để tạo điều kiện thuận lợi cho cơ học phổi, cải thiện huy động bài tiết, và tránh hít sặc.
|
BẢNG 7 Điểm chính |
|
Thông khí áp lực dương làm giảm tiền tải RV, tăng hậu tải RV và giảm hậu tải LV. |
|
Oxy lưu lượng cao có thể tránh được nhu cầu thông khí áp lực dương ở một số bệnh nhân. |
|
PEEP rất hữu ích cho quá trình oxy hóa và để tránh hoặc điều trị xẹp phổi, nhưng cũng có thể hữu ích trong việc giảm tải cho LV bị suy. |
|
Auto-PEEP nên được theo dõi ở những bệnh nhân có gia tăng sức cản đường thở, tăng bơm khí hoặc kích hoạt không hiệu quả, và có thể dẫn đến mất ổn định huyết động hoặc chấn thương khí áp. |
|
Nên tránh áp lực dương nếu có thể, hoặc sử dụng thận trọng, trong các điều kiện phụ thuộc vào việc đổ đầy RV, như tăng áp phổi cấp tính, suy RV và chèn ép tim cấp. |
|
BiPAP được ưu tiên hơn CPAP khi có nhu cầu giảm công hô hấp và / hoặc cải thiện thông khí ở bệnh nhân tăng CO2 máu. |
Trong số những bệnh nhân vượt qua SBT nhưng có nguy cơ rút ống thất bại cao, NI-PPV và HFNC đưa ra các lựa chọn để cải thiện thành công trong giai đoạn sau rút ống. Các chỉ số về nguy cơ thất bại cao là phổ biến trong dân số CICU: tuổi> 65 tuổi, béo phì (chỉ số khối cơ thể ≥ 35 kg / m2), suy tim và tiền sử mắc các bệnh kèm theo tim khác (125.126). Các hướng dẫn của Trường môn bác sĩ ngực và Hiệp hội lồng ngực Hoa Kỳ đưa ra "khuyến cáo mức độ mạnh" cho NI-PPV sau rút ống ở những bệnh nhân có nguy cơ cao (125). Nếu chiến lược này được thực hiện, NI-PPV nên được áp dụng ngay sau khi rút ống. Áp dụng NIPPV sau khi phát triển suy hô hấp sau rút ống có thể gây bất lợi do trì hoãn việc đặt ống NKQ lại (127).
KẾT LUẬN
Các bác sĩ thực hành tim mạch trong CICU nên làm quen với tác dụng của PPV đối với sinh lý tim phổi để có thể điều chỉnh và quản lý máy thở để tối ưu hóa huyết động, oxy hóa và thông khí (Bảng 7). Khi khoa hồi sức tim mạch tiếp tục phát triển, các nghiên cứu quản lý thông khí chuyên dụng trong CICU có tầm quan trọng cao để đạt được mục tiêu này.
TÀI LIỆU THAM KHẢO
Morrow DA, Fang JC, Fintel DJ, et al. Evolution of critical care cardiology: transformation of the cardiovascular intensive care unit and the emerging need for new medical staffing and training models: a scientific statement from the American Heart Association. Circulation 2012;126:1408 -28.
Katz JN, Shah BR, Volz EM, et al. Evolution of the coronary care unit: clinical characteristics and temporal trends in healthcare delivery and outcomes. Crit Care Med 2010;38:375–81.
Morrow DA. Trends in cardiac critical care: reshaping the cardiac intensive care unit. Circ Cardiovasc Qual Outcomes 2017;10:e004010.
Sinha SS, Sjoding MW, Sukul D, et al. Changes in primary noncardiac diagnoses over time among elderly cardiac intensive care unit patients in the United States. Circ Cardiovasc Qual Outcomes 2017;10:e003616.
Metkus TS, Albaeni A, Chandra-Strobos N, Eid SM. Incidence and prognostic impact of respiratory support in patients with ST-segment elevation myocardial infarction. Am J Cardiol 2017;119:171–7.
Feihl F, Broccard AF. Interactions between respiration and systemic hemodynamics. Part I: basic concepts. Intensive Care Med 2009;35: 45–54.
Feihl F, Broccard AF. Interactions between respiration and systemic hemodynamics. Part II: practical implications in critical care. Intensive Care Med 2009;35:198–205.
Truwitt JD. Lung mechanics. In: Dantzer DR, MacIntyre N, Bakow ED, editors. Comprehensive Respiratory Care. Philadelphia: WB Saunders Co, 1995:18–31.
Coruh B, Tonelli MR, Park DR. Fentanyl-induced chest wall rigidity. Chest 2013;143:1145–6.
Grinnan DC, Truwit JD. Clinical review: respiratory mechanics in spontaneous and assisted ventilation. Crit Care 2005;9:472–84.
Rodarte JR, Rehder K. Dynamics of respiration. In: Macklem PT, Mead J, editors. American Physiological Society Handbook of Physiology. Bethesda, MD: American Physiological Society, 1986:131–44.
Esteban A, Anzueto A, Frutos F, et al. Characteristics and outcomes in adult patients receiving mechanical ventilation: a 28-day international study. JAMA 2002;287:345–55.
Brower RG, Lanken PN, MacIntyre N, et al. Higher versus lower positive endexpiratory pressures in patients with the acute respiratory distress syndrome. N Engl J Med 2004;351: 327–36.
Pang D, Keenan SP, Cook DJ, Sibbald WJ. The effect of positive pressure airway support on mortality and the need for intubation in cardiogenic pulmonary edema: a systematic review. Chest 1998;114:1185–92.
Magder SA, Lichtenstein S, Adelman AG. Effect of negative pleural pressure on left ventricular hemodynamics. Am J Cardiol 1983;52:588–93.
Rankin JS, Olsen CO, Arentzen CE, et al. The effects of airway pressure on cardiac function in intact dogs and man. Circulation 1982;66:108–20.
Cheifetz IM. Cardiorespiratory interactions: the relationship between mechanical ventilation and hemodynamics. Respir Care 2014;59:1937–45.
Patzelt J, Zhang Y, Seizer P, et al. Effects of mechanical ventilation on heart geometry and mitral valve leaflet coaptation during percutaneous edge-toedge mitral valve repair. J Am Coll Cardiol Intv 2016;9:151–9.
Tkacova R, Liu PP, Naughton MT, Bradley TD. Effect of continuous positive airway pressure on mitral regurgitant fraction and atrial natriuretic peptide in patients with heart failure. J Am Coll Cardiol 1997;30:739–45.
Cassidy SS, Ramanathan M. Dimensional analysis of the left ventricle during PEEP: relative septal and lateral wall displacements. Am J Physiol 1984;246:H792–805.
Haddad F, Doyle R, Murphy DJ, Hunt SA. Right ventricular function in cardiovascular disease, part II: pathophysiology, clinical importance, and management of right ventricular failure. Circulation 2008;117:1717–31.
Robotham JL, Lixfeld W, Holland L, et al. The effects of positive end-expiratory pressure on right and left ventricular performance. Am Rev Respir Dis 1980;121:677–83.
Nanas S, Magder S. Adaptations of the peripheral circulation to PEEP. Am Rev Respir Dis 1992;146:688–93.
Price LC, Wort SJ, Finney SJ, Marino PS, Brett SJ. Pulmonary vascular and right ventricular dysfunction in adult critical care: current and emerging options for management: a systematic literature review. Crit Care 2010;14:R169.
Petersson J, Ax M, Frey J, Sanchez-Crespo A, Lindahl SG, Mure M. Positive endexpiratory pressure redistributes regional blood flow and ventilation differently in supine and prone humans.Anesthesiology 2010;113:1361–9.
Tomashefski JF Jr., Davies P, Boggis C, Greene R, Zapol WM, Reid LM. The pulmonary vascular lesions of the adult respiratory distress syndrome. Am J Pathol 1983;112:112–26.
Green EM, Givertz MM. Management of acute right ventricular failure in the intensive care unit. Curr Heart Fail Rep 2012;9:228–35.
Marini JJ. Dynamic hyperinflation and autopositive end-expiratory pressure: lessons learned over 30 years. Am J Respir Crit Care Med 2011;184: 756–62.
Hernandez G, Roca O, Colinas L. High-flow nasal cannula support therapy: new insights and improving performance. Crit Care 2017;21:62.
Lee JH, Rehder KJ, Williford L, Cheifetz IM, Turner DA. Use of high flow nasal cannula in critically ill infants, children, and adults: a critical review of the literature. Intensive Care Med 2013; 39:247–57.
Frat JP, Thille AW, Mercat A, et al. High-flow oxygen through nasal cannula in acute hypoxemic respiratory failure. N Engl J Med 2015;372: 2185–96.
Stephan F, Barrucand B, Petit P, et al. Highflow nasal oxygen vs noninvasive positive airway pressure in hypoxemic patients after cardiothoracic surgery: a randomized clinical trial. JAMA 2015;313:2331–9.
Spoletini G, Alotaibi M, Blasi F, Hill NS. Heated humidified high-flow nasal oxygen in adults: mechanisms of action and clinical implications. Chest 2015;148:253–61.
Organized Jointly by the American Thoracic Society, the European Respiratory Society, the European Society of Intensive Care Medicine, and the Société de Réanimation de Langue Française, and approved by the ATS Board of Directors, December 2000. International consensus conferences in intensive care medicine: noninvasive positive pressure ventilation in acute Respiratory failure. Am J Respir Crit Care Med 2001;163:283–91.
Girault C, Briel A, Benichou J, et al. Interface strategy during noninvasive positive pressure ventilation for hypercapnic acute respiratory failure. Crit Care Med 2009;37:124–31.
Hess D, Kacmarek RM. Essentials of Mechanical Ventilation. Third edition. New York: McGraw Hill Education, Medical Publishing Division, 2014.
Girardis M, Busani S, Damiani E, et al. Effect of conservative vs conventional oxygen therapy on mortality among patients in an intensive care unit: The Oxygen-ICU Randomized Clinical Trial. JAMA 2016;316:1583–9.
Stub D, Smith K, Bernard S, et al. Air versus oxygen in ST-segment-elevation myocardial infarction. Circulation 2015;131:2143–50.
Roberts BW, Kilgannon JH, Hunter BR, et al. Association between early hyperoxia exposure after resuscitation from cardiac arrest and neurological disability: prospective multicenter protocol-directed cohort study. Circulation 2018; 137:2114–24.
Gay PC. Complications of noninvasive ventilation in acute care. Respir Care 2009;54:246–57.
Gray A, Goodacre S, Newby DE, et al. Noninvasive ventilation in acute cardiogenic pulmonary edema. N Engl J Med 2008;359:142–51.
Chatburn RL, El-Khatib M, MirelesCabodevila E. A taxonomy for mechanical ventilation: 10 fundamental maxims. Respir Care 2014; 59:1747–63.
Porhomayon J, El-Solh AA, Nader ND. Applications of airway pressure release ventilation. Lung 2010;188:87–96.
Scharf SM, Bianco JA, Tow DE, Brown R. The effects of large negative intrathoracic pressure on left ventricular function in patients with coronary artery disease. Circulation 1981;63:871–5.
Corredor C, Jaggar SI. Ventilator management in the cardiac intensive care unit. Cardiol Clin 2013;31:619–36, ix.
Dursun A, Okumus N, Erol S, Bayrak T, Zenciroglu A. Effect of ventilation support on J A C C V O L . 7 2 , N O . 1 3 , 2 0 1 8 Alviar et al. S E P T E M B E R 2 5 , 2 0 1 8 : 1 5 3 2 – 5 3 Positive Pressure Ventilation 1551 oxidative stress and ischemia-modified albumin in neonates. Am J Perinatol 2016;33:136–42.
Goligher EC, Dres M, Fan E, et al. Mechanical ventilation-induced diaphragm atrophy strongly impacts clinical outcomes. Am J Respir Crit Care Med 2018;197:204–13.
Shorofsky M, Jayaraman D, Lellouche F, Husa R, Lipes J. Mechanical ventilation with high tidal volume and associated mortality in the cardiac intensive care unit. Acute Card Care 2014;16: 9–14.
Chadda K, Annane D, Hart N, Gajdos P, Raphael JC, Lofaso F. Cardiac and respiratory effects of continuous positive airway pressure and noninvasive ventilation in acute cardiac pulmonary edema. Crit Care Med 2002;30:2457–61.
Masip J, Betbese AJ, Paez J, et al. Non-invasive pressure support ventilation versus conventional oxygen therapy in acute cardiogenic pulmonary oedema: a randomised trial. Lancet 2000;356:2126–32.
Park M, Sangean MC, Volpe Mde S, et al. Randomized, prospective trial of oxygen, continuous positive airway pressure, and bilevel positive airway pressure by face mask in acute cardiogenic pulmonary edema. Crit Care Med 2004;32: 2407–15.
Kulkarni VT, Kim N, Dai Y, et al. Hospital variation in noninvasive positive pressure ventilation for acute decompensated heart failure. Circ Heart Fail 2014;7:427–33.
Vital FM, Ladeira MT, Atallah AN. Non-invasive positive pressure ventilation
(CPAP or bilevel NPPV) for cardiogenic pulmonary oedema. Cochrane Database Syst Rev 2013:CD005351.
Weng CL, Zhao YT, Liu QH, et al. Meta-analysis: Noninvasive ventilation in acute cardiogenic pulmonary edema. Ann Intern Med 2010;152: 590–600.
Mebazaa A, Yilmaz MB, Levy P, et al. Recommendations on pre-hospital and early hospital management of acute heart failure: a consensus paper from the Heart Failure Association of the European Society of Cardiology, the European Society of Emergency Medicine and the Society of Academic Emergency Medicine—short version. Eur Heart J 2015;36:1958–66.
Anton A, Guell R, Gomez J, et al. Predicting the result of noninvasive ventilation in severe acute exacerbations of patients with chronic airflow limitation. Chest 2000;117:828–33.
Ariza Sole A, Salazar-Mendiguchia J, LorenteTordera V, et al. Invasive mechanical ventilation in acute coronary syndromes in the era of percutaneous coronary intervention. Eur Heart J Acute Cardiovasc Care 2013;2:109–17.
Thiele H, Zeymer U, Neumann FJ, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med 2012; 367:1287–96.
Puymirat E, Fagon JY, Aegerter P, et al. Cardiogenic shock in intensive care units: evolution of prevalence, patient profile, management and outcomes, 1997–2012. Eur J Heart Fail 2017; 19:192–200.
Fessler HE, Brower RG, Wise RA, Permutt S. Mechanism of reduced LV afterload by systolic and diastolic positive pleural pressure. J Appl Physiol (1985) 1988;65:1244–50.
Grace MP, Greenbaum DM. Cardiac performance in response to PEEP in patients with cardiac dysfunction. Crit Care Med 1982;10:358–60.
Bellone A, Barbieri A, Ricci C, et al. Acute effects of non-invasive ventilatory support on functional mitral regurgitation in patients with exacerbation of congestive heart failure. Intensive Care Med 2002;28:1348–50.
Calvin JE, Driedger AA, Sibbald WJ. Positive end-expiratory pressure (PEEP) does not depress left ventricular function in patients with pulmonary edema. Am Rev Respir Dis 1981;124:121–8.
Wiesen J, Ornstein M, Tonelli AR, Menon V, Ashton RW. State of the evidence: mechanical ventilation with PEEP in patients with cardiogenic shock. Heart 2013;99:1812–7.
Peters J. Mechanical ventilation with PEEP—a unique therapy for failing hearts. Intensive Care Med 1999;25:778–80.
Kontoyannis DA, Nanas JN, Kontoyannis SA, Stamatelopoulos SF, Moulopoulos SD. Mechanical ventilation in conjunction with the intra-aortic balloon pump improves the outcome of patients in profound cardiogenic shock. Intensive Care Med 1999;25:835–8.
Mathru M, Rao TL, El-Etr AA, Pifarre R. Hemodynamic response to changes in ventilatory patterns in patients with normal and poor left ventricular reserve. Crit Care Med 1982;10:423–6.
Hoeper MM, Granton J. Intensive care unit management of patients with severe pulmonary hypertension and right heart failure. Am J Respir Crit Care Med 2011;184:1114–24.
Aqel RA, Aljaroudi W, Hage FG, Tallaj J, Rayburn B, Nanda NC. Left ventricular collapse secondary to pericardial effusion treated with pericardicentesis and percutaneous pericardiotomy in severe pulmonary hypertension. Echocardiography 2008;25:658–61.
Balanos GM, Talbot NP, Dorrington KL, Robbins PA. Human pulmonary vascular response to 4 h of hypercapnia and hypocapnia measured using Doppler echocardiography. J Appl Physiol (1985) 2003;94:1543–51.
Jardin F, Vieillard-Baron A. Right ventricular function and positive pressure ventilation in clinical practice: from hemodynamic subsets to respirator settings. Intensive Care Med 2003;29: 1426–34.
Paternot A, Repesse X, Vieillard-Baron A. Rationale and description of right ventricle protective ventilation in ARDS. Respir Care 2016; 61:1391–6.
Malik AB, Kidd BS. The independent effects of changes in H þ and CO 2 concentrations on pulmonary hemodynamics of intact dogs. Can J Physiol Pharmacol 1973;51:139–47.
Grasso S, Terragni P, Mascia L, et al. Airway pressure-time curve profile (stress index) detects tidal recruitment/hyperinflation in experimental acute lung injury. Crit Care Med 2004;32:1018–27.
Henderson WR, Chen L, Amato MBP, Brochard LJ. Fifty years of research in ARDS. Respiratory mechanics in acute respiratory distress syndrome. Am J Respir Crit Care Med 2017;196: 822–33.
Vieillard-Baron A, Charron C, Caille V, Belliard G, Page B, Jardin F. Prone positioning unloads the right ventricle in severe ARDS. Chest 2007;132:1440–6.
Harjola VP, Mebazaa A, Celutkiene J, et al. Contemporary management of acute right ventricular failure: a statement from the Heart Failure Association and the Working Group on Pulmonary Circulation and Right Ventricular Function of the European Society of Cardiology. Eur J Heart Fail 2016;18:226–41.
Ho AM, Graham CA, Ng CS, et al. Timing of tracheal intubation in traumatic cardiac tamponade: a word of caution. Resuscitation 2009;80: 272–4.
Thiagarajan RR, Barbaro RP, Rycus PT, et al. Extracorporeal Life Support Organization Registry International Report 2016. ASAIO J 2017;63:60–7.
Miller PE, Solomon MA, McAreavey D. Advanced percutaneous mechanical circulatory support devices for cardiogenic shock. Crit Care Med 2017;45:1922–9.
Extracorporeal Life Support Organization. ELSO Guidelines for Cardiopulmonary Extracorporeal Life Support. Ann Arbor, MI: Extracorporeal Life Support Organization, 2017.
Marhong JD, Telesnicki T, Munshi L, Del Sorbo L, Detsky M, Fan E. Mechanical ventilation during extracorporeal membrane oxygenation. An international survey. Ann Am Thorac Soc 2014;11:956–61.
Schmidt M, Pellegrino V, Combes A, Scheinkestel C, Cooper DJ, Hodgson C. Mechanical ventilation during extracorporeal membrane oxygenation. Crit Care 2014;18:203.
Peek GJ, Mugford M, Tiruvoipati R, et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet 2009;374:1351–63.
Preslaski CR, Lat I, MacLaren R, Poston J. Pharmacist contributions as members of the multidisciplinary ICU team. Chest 2013;144: 1687–95.
Shulman R, McKenzie CA, Landa J, et al. Pharmacist’s review and outcomes: Treatmentenhancing contributions tallied, evaluated, and documented (PROTECTED-UK). J Crit Care 2015; 30:808–13.
deBacker J, Hart N, Fan E. Neuromuscular blockade in the 21st century management of the critically ill patient. Chest 2017;151:697–706.
Barr J, Fraser GL, Puntillo K, et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med 2013;41: 263–306.
Cavalcanti AB, Suzumura ÉA, Laranjeira LN, et al., for the Writing Group for the Alveolar Recruitment for Acute Respiratory Distress Alviar et al. J A C C V O L . 7 2 , N O . 1 3 , 2 0 1 8 Positive Pressure Ventilation S E P T E M B E R 2 5 , 2 0 1 8 : 1 5 3 2 – 5 3 1552 Syndrome Trial Investigators. Effect of lung recruitment and titrated positive end-expiratory pressure (PEEP) vs low PEEP on mortality in patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA 2017;318:1335–45.
Meade MO, Cook DJ, Guyatt GH, et al. Ventilation strategy using low tidal volumes, recruitment maneuvers, and high positive end-expiratory pressure for acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. JAMA 2008;299:637–45.
Briel M, Meade M, Mercat A, et al. Higher vs lower positive end-expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome: systematic review and metaanalysis. JAMA 2010;303:865–73.
Bollen CW, van Well GT, Sherry T, et al. High frequency oscillatory ventilation compared with conventional mechanical ventilation in adult respiratory distress syndrome: a randomized controlled trial [ISRCTN24242669]. Crit Care 2005;9:R430–9.
Derdak S, Mehta S, Stewart TE, et al. Highfrequency oscillatory ventilation for acute respiratory distress syndrome in adults: a randomized, controlled trial. Am J Respir Crit Care Med 2002; 166:801–8.
Sud S, Sud M, Friedrich JO, et al. High frequency oscillation in patients with acute lung injury and acute respiratory distress syndrome (ARDS): systematic review and meta-analysis. BMJ 2010;340:c2327.
Papazian L, Forel JM, Gacouin A, et al. Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med 2010;363: 1107–16.
Taccone P, Pesenti A, Latini R, et al. Prone positioning in patients with moderate and severe acute respiratory distress syndrome: a randomized controlled trial. JAMA 2009;302:1977–84.
Sud S, Friedrich JO, Taccone P, et al. Prone ventilation reduces mortality in patients with acute respiratory failure and severe hypoxemia: systematic review and meta-analysis. Intensive Care Med 2010;36:585–99.
Guerin C, Reignier J, Richard JC, et al. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med 2013;368:2159–68.
Pelosi P, Brazzi L, Gattinoni L. Prone position in acute respiratory distress syndrome. Eur Respir J 2002;20:1017–28.
Taylor RW, Zimmerman JL, Dellinger RP, et al. Low-dose inhaled nitric oxide in patients with acute lung injury: a randomized controlled trial. JAMA 2004;291:1603–9.
Adhikari NK, Burns KE, Friedrich JO, Granton JT, Cook DJ, Meade MO. Effect of nitric oxide on oxygenation and mortality in acute lung injury: systematic review and meta-analysis. BMJ 2007;334:779.
Lundin S, Mang H, Smithies M, Stenqvist O, Frostell C, for the European Study Group of Inhaled Nitric Oxide. Inhalation of nitric oxide in acute lung injury: results of a European multicentre study. Intensive Care Med 1999;25:911–9.
Gries A, Herr A, Kirsch S, et al. Inhaled nitric oxide inhibits platelet-leukocyte interactions in patients with acute respiratory distress syndrome. Crit Care Med 2003;31:1697–704.
Gebistorf F, Karam O, Wetterslev J, Afshari A. Inhaled nitric oxide for acute respiratory distress syndrome (ARDS) in children and adults. Cochrane Database Syst Rev 2016:CD002787.
Slutsky AS, Ranieri VM. Ventilator-induced lung injury. N Engl J Med 2013;369:2126–36.
Serpa Neto A, Cardoso SO, Manetta JA, et al. Association between use of lungprotective ventilation with lower tidal volumes and clinical outcomes among patients without acute respiratory distress syndrome: a meta-analysis. JAMA 2012;308:1651–9.
Neto AS, Simonis FD, Barbas CS, et al. Lungprotective ventilation with low tidal volumes and the occurrence of pulmonary complications in patients without acute respiratory distress syndrome: a systematic review and individual patient data analysis. Crit Care Med 2015;43:2155–63.
Thompson BT, Chambers RC, Liu KD. Acute respiratory distress syndrome. N Engl J Med 2017; 377:562–72.
Decailliot F, Demoule A, Maggiore SM, Jonson B, Duvaldestin P, Brochard L. Pressurevolume curves with and without muscle paralysis in acute respiratory distress syndrome. Intensive Care Med 2006;32:1322–8.
Talmor D, Sarge T, Malhotra A, et al. Mechanical ventilation guided by esophageal pressure in acute lung injury. N Engl J Med 2008;359: 2095–104.
Safdar N, Dezfulian C, Collard HR, Saint S. Clinical and economic consequences of ventilatorassociated pneumonia: a systematic review. Crit Care Med 2005;33:2184–93.
Ensminger SA, Wright RS, Baddour LM, Afessa B. Suspected ventilatorassociated pneumonia in cardiac patients admitted to the coronary care unit. Mayo Clin Proc 2006;81:32–5.
Alexiou VG, Ierodiakonou V, Dimopoulos G, Falagas ME. Impact of patient position on the incidence of ventilator-associated pneumonia: a meta-analysis of randomized controlled trials. J Crit Care 2009;24:515–22.
Girard TD, Kress JP, Fuchs BD, et al. Efficacy and safety of a paired sedation and ventilator weaning protocol for mechanically ventilated patients in intensive care (Awakening and Breathing Controlled trial): a randomised controlled trial. Lancet 2008;371:126–34.
Morris AC, Hay AW, Swann DG, et al. Reducing ventilator-associated pneumonia in intensive care: impact of implementing a care bundle. Crit Care Med 2011;39:2218–24.
Muscedere J, Rewa O, McKechnie K, Jiang X, Laporta D, Heyland DK. Subglottic secretion drainage for the prevention of ventilator-associated pneumonia: a systematic review and meta-analysis. Crit Care Med 2011;39:1985–91.
Dasta JF, McLaughlin TP, Mody SH, Piech CT. Daily cost of an intensive care unit day: the contribution of mechanical ventilation. Crit Care Med 2005;33:1266–71.
Seymour CW, Martinez A, Christie JD, Fuchs BD. The outcome of extubation failure in a community hospital intensive care unit: a cohort study. Crit Care 2004;8:R322–7.
Liu J, Shen F, Teboul JL, et al. Cardiac dysfunction induced by weaning from mechanical ventilation: incidence, risk factors, and effects of fluid removal. Crit Care 2016;20:369.
Girard TD, Alhazzani W, Kress JP, et al. An official American Thoracic Society/American College of Chest Physicians clinical practice guideline: liberation from mechanical ventilation in critically ill adults. rehabilitation protocols, ventilator liberation protocols, and cuff leak tests. Am J Respir Crit Care Med 2017;195:120–33.
Hernandez G, Vaquero C, Colinas L, et al. Effect of postextubation high-flow nasal cannula vs noninvasive ventilation on reintubation and postextubation respiratory failure in high-risk patients: a randomized clinical trial. JAMA 2016;316: 1565–74.
Tobin MJ. Extubation and the myth of “minimal ventilator settings.” Am J Respir Crit Care Med 2012;185:349–50.
McConville JF, Kress JP. Weaning patients from the ventilator. N Engl J Med 2012;367:2233–9.
Ruiz-Bailen M, Cobo-Molinos J, CastilloRivera A, et al. Stress echocardiography in patients who experienced mechanical ventilation weaning failure. J Crit Care 2017;39:66–71.
Ouellette DR, Patel S, Girard TD, et al. Liberation from mechanical ventilation in critically ill adults: an official American College of Chest Physicians/American Thoracic Society clinical practice guideline: inspiratory pressure augmentation during spontaneous breathing trials, protocols minimizing sedation, and noninvasive ventilation immediately after extubation. Chest 2017;151:166–80.
Thille AW, Harrois A, Schortgen F, BrunBuisson C, Brochard L. Outcomes of extubation failure in medical intensive care unit patients. Crit Care Med 2011;39:2612–8.
Esteban A, Frutos-Vivar F, Ferguson ND, et al. Noninvasive positive-pressure ventilation for respiratory failure after extubation. N Engl J Med 2004;350:2452–60.
-
Tài liệu mới nhất
-
Quy chế phát ngôn và cung cấp thông tin cho báo chí của Bộ Y tế
20:56,31/01/2023
-
Chụp CL trở kháng điện để chuẩn độ AL dương cuối thì thở ra trong HC nguy kịch hô hấp cấp tính
15:41,31/01/2023
-
Các kịch bản lâm sàng của ứng dụng chụp cắt lớp trở kháng điện trong chăm sóc tích cực ở trẻ em
22:41,30/01/2023
-
Thông khí hướng dẫn bằng áp lực đẩy so với thông khí bảo vệ phổi ở bệnh nhân ARDS
22:08,12/01/2023
-
Áp lực đẩy và áp lực xuyên phổi: Làm thế nào để chúng tôi hướng dẫn thông khí cơ học an toàn?
22:49,10/01/2023
-
Chuẩn năng lực cơ bản của Cử nhân Dinh dưỡng Việt Nam
20:54,09/01/2023
-
Giảm viêm phổi liên quan đến thở máy ở khoa chăm sóc đặc biệt cho trẻ sơ sinh
21:50,08/01/2023
-
Các chiến lược ngăn ngừa viêm phổi liên quan đến thở máy,...
10:33,07/01/2023
-
Hướng dẫn chẩn đoán, điều trị, phòng và kiểm soát lây nhiễm bệnh do vi rút Adeno ở trẻ em
21:16,06/01/2023
-
Chuẩn năng lực cơ bản của Cử nhân Điều dưỡng Việt Nam
20:31,05/01/2023
-
Quy chế phát ngôn và cung cấp thông tin cho báo chí của Bộ Y tế







